{신재생]
연료전지
신재생에너지의 하나인 연료전지 발전 원리와 현황을 알아봅니다.
연료전지는 우리나라 '신에너지 및 재생에너지 개발 이용 보급 촉진법'에 따른 신재생에너지 중의 하나입니다. 주로 수소를 연료로 사용하기 때문에 수소연료전지라고도 합니다. '수소연료를 사용하는 전기 발생장치'라고 말할 수 있습니다.
연료전지에 대하여 설명하기 전에 먼저 '연료', '연소' 등에 대하여 살펴보겠습니다.
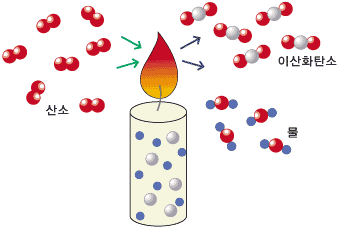
'연료를 연소시킨다' 또는 '연료를 태운다'는 의미는 연료를 산소와 반응시키는 것을 말하며, 그러면 그 반응 과정에서 열이 생성되고, 이렇게 생성되는 열을 우리는 다양하게 이용하게 됩니다.
[일반 연소]
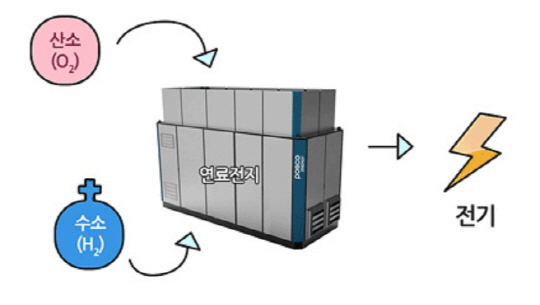
[전기화학적 연소]
전기화학적인 방법을 이용하면 연료의 연소를 이용하여 직접 전기로도 변환시킬 수 있습니다. 이것이 바로 연료전지입니다. 연료전지는 직접 전기를 생산하는 장치로 1차 전지와 유사합니다. 1차 전지는 화학적으로 저장된 에너지를 사용하고 나면 다시 충전하여 본래의 상태로 되돌릴 수 없는 비가역적 화학반응을 하는 전지입니다.
2차 전지란 사용 후 충전을 통해 다시 원래의 상태로 되돌릴 수 있는 반영구적으로 사용할 수 있는 전지를 말하며 이를 축전지(battery)라고 합니다. 사실 2차 전지는 전기생성 장치라고 보기보다는 외부 전기를 저장했다 필요할 때 꺼내 사용하는 장치라고 볼 수 있습니다.
(연료전지 ≒ 1차 전지) ≠ (2차전지 = 축전지 = battery)
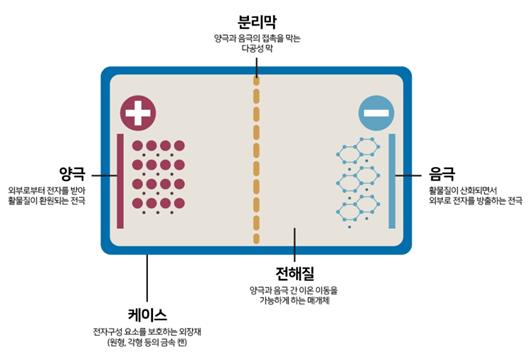
연료전지는 언듯 보기에는 간단해보이지만 실제로 그 안으로 들여다보면 구조가 조금 복잡합니다.
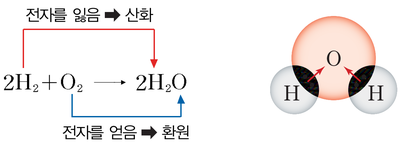
비교를 위해 먼저 연소에 대하여 설명드리겠습니다. 연료로 수소를 사용한다고 가정하겠습니다. 연소란 수소를 직접 산소와 반응시키는 것이고, 이때 수소에 있는 전자가 산소로 이동되면서 수소와 산소는 화학결합을 하게됩니다. 그러면 물이 생성되고, 열이 발생됩니다.
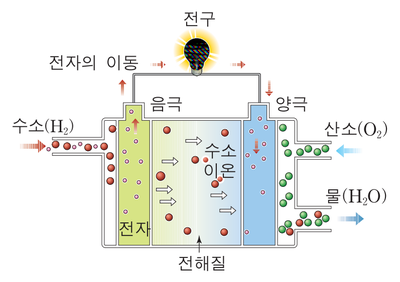
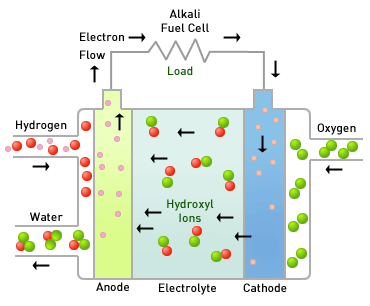
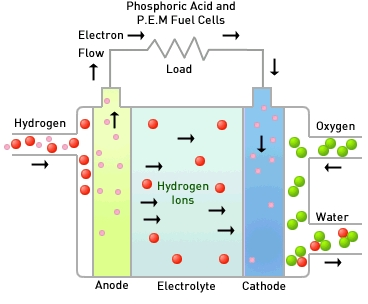
수소와 산소를 직접 결합하지 못하게 하기 위해 그 사이를 전해질과 분리막으로 가로막습니다. 그 다음 수소는 음극으로 산소는 양극으로 주입합니다. 전해질 양쪽 끝에는 다공성 전극을 두고, 양쪽 전극을 도선으로 연결합니다. 어떻게 될까요?
수소는 먼저와 마찬가지로 수소이온과 전자로 분리됩니다. 그리고 전자는 음극에서 도선을 따라 양극으로 이동하고 수소이온은 전해질을 통해 음극에서 양극으로 이동하게 됩니다. 수소이온과 전자는 양극에서 산소와 합쳐져 물이 생성됩니다. 아까와 어떻게 다르냐구요? 다른 점은 바로 도선을 통과하는 전기가 발생되었다는 것입니다.
이는 음극와 양극의 전위(에너지 준위)차에 의하여 발생되는 현상이며 전류가 흐르는 만큼만 전기화학반응이 일어납니다. 도선을 연결하여 두 전위의 전위차 및 흐르는 전류 만큼의 에너지를 이용할 수 있게 되며 이것이 연료전지 발전의 원리입니다.
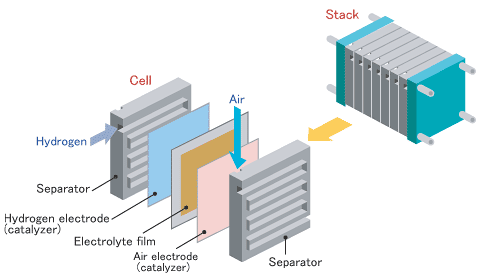
지금까지 설명한 것을 연료전지 단위 셀(cell이라고 부릅니다. 전기를 많이 생산하기 위하여 이와 같은 단위셀을 여러 층 쌓아(stack) 만들면 연료전지 발전소가 됩니다.
단위 셀은 연료극 전극(electrode), 전해질 분리막(electrolyte film), 공기극 전극(electrode)으로 구성되어 있고, 단위 셀과 셀 사이에는 분리막(separator)이 있습니다.
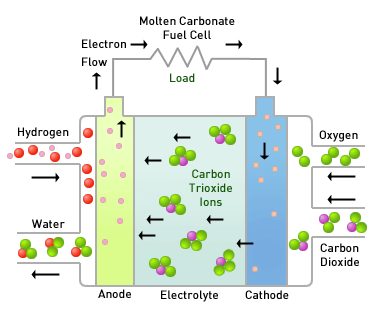
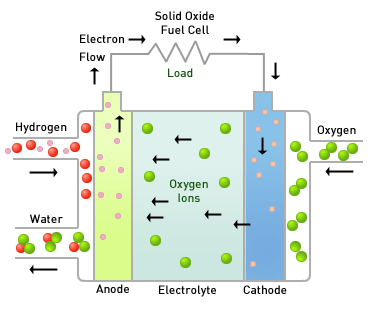
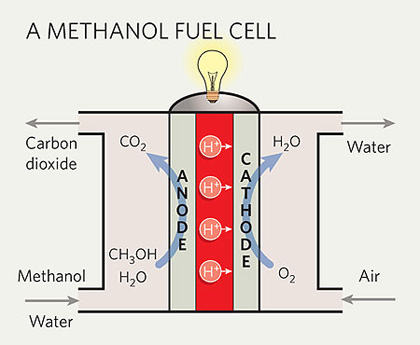
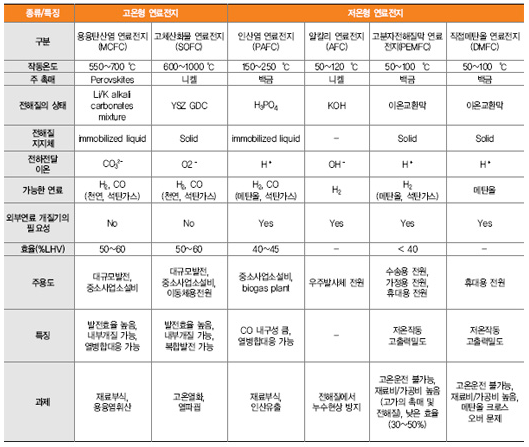
연료전지에는 전해질의 종류에 따라 알칼리형연료전지(AFC), 인산형연료전지(PAFC), 용융탄산연연료전지(MCFC), 고체산화물연료전지(SOFC), 고분자전해질연료전지(PEMFC), 직접메탄올연료전지(DMFC)가 있습니다.
이들 연료전지의 특성은 다음과 같습니다.
연료전지는 작동 온도가 높을수록 전기화학 반응속도가 높아지기 때문에 효율이 높아집니다. 그러나 작동 온도가 높을수록 높은 온도까지 도달하여야 하므로 기동시간이 길어지고, 고온 실링, 열 사이클 문제 등을 해결하여야 합니다.
연료전지는 탄화수소계열의 연료를 사용하며, PEMFC와 같이 수소를 연료로 사용하는 경우에는 탄화수소계열의 연료를 사용하려면 미리 탄화수소에서 수소를 떼어내는 개질반응을 거쳐야 합니다. 고온에서 작동하는 MCFC나 SOFC는 연료전지 발전장치 내에서 탄화수소에서 수소룰 떼어내는 '내부 개질'이 가능하며, 내부개질시 발생되는 CO가 촉매에 크게 영향을 미치지 않으므로 가솔린과 천연가스 그 자체를 직접 연료로 사용하는 것까지 가능합니다. 또한 DMFC는 효울은 떨어지지만 개질부가 필요없어 소형화가 가능합니다.
고온에서 작동되면 Ni과 같이 비교적 저렴한 촉매를 사용할 수 있으며, 저온에서 작동되면 기동시간이 짧고 소형화가 가능하나 저온에서 사용할 수 있는 촉매로는 Pt 같은 귀금속류밖에 없습니다.
현재 연료전지 발전에는 포스코에너지에서 만드는 MCFC 연료전지와 두산퓨얼셀에서 만드는 PAFC 연료전지 두 종류가 사용되고 있습니다. 고온에서 작동되어 발전효율이 높은 것이 특징이지요.
반면, 수소연료전지자동차에 사용되는 연료전지는 PEMFC입니다. 저온에서 작동되는 것이 특징이지요.
흔히 연료전지 발전은 천연가스에서 수소를 추출해내기 위해 천연가스 중 탄소는 태우고 남는 수소를 사용하므로 이산화탄소도 방출되고, 에너지도 낭비되는 비효율적인 연소방법이라고 오해하는 경우가 있습니다.
그러나 연료전지 발전은 천연가스에 있는 탄소를 태우고 남는 수소를 사용하는 것은 아닙니다. 연료전지에 사용되는 수소는 천연가스를 수증기 개질하여 생산합니다. 먼저 수증기 개질에 대하여 설명하겠습니다.
MCFC나 SOFC 연료전지 발전소는 650 ℃ 이상의 고온에서 반응이 일어나기 때문에 그 열을 이용하여 물을 고온의 수증기로 만들 수 있습니다. 이 고온의 수증기를 이용하여 천연가스를 개질시킵니다. 메탄의 예를 들겠습니다. 다음 수식이 메탄의 수증기 개질 화학방정식입니다.
메탄 한 분자와 물 두 분자가 만나서 수소 네 분자와 이산화탄소 한 분자가 생성됩니다. 메탄에 있는 수소는 그대로 추출됩니다. 메탄에 있는 탄소는 물에 있는 수소와 치환됩니다. 물의 입장에서 보면 수소가 없어지고 탄소로 바뀌는 것입니다. 즉, 물이 이산화탄소로 변환되는 것입니다. 그런데 반응전 메탄의 에너지 보다 반응 후 생성된 수소의 에너지가 더 에너지가 높습니다. 이런 반응을 열을 흡수하는 반응이라고 하여 흡열반응이라고 합니다.
이렇게 생각하시는 분도 계실 것입니다. 어쨌든 결국 탄소가 연소되어 이산화탄소가 생성되지 않았느냐구요. 그건 맞습니다. 그렇지만 메탄 에너지를 사용하지 않고 원자력이나 재생 에너지를 사용한다면 모를까 어차피 메탄을 연료로 사용할 것이면 단순히 메탄을 연소시키는 것보다 연료전지로 발전하는 것이 장점이 많다는 이야기입니다.
수소자동차 편에서 설명드렸듯이 수소를 이용한 화력발전 효율은 45~50% 정도이지만, 보일러 열손실과 발전시설 소모 전력, 여기에 우리나라 송전손실율 3%와 배터리에 충방전시 85% 정도만 재생되는 것을 감안하면 최종적으로 발전효율은 31%라고 볼 수 있습니다.
그러나 MCFC 연료전지 발전효율은 40~45 %, SOFC 연료전지 발전효율은 60 % 가까이 기대하고 있습니다. 또한 주택가나 산업단지 등에 가깝게 건설할 수 있기 때문에 발생되는 열을 난방에 활용할 수도 있습니다. 온실가스를 저감시킬 수 있는 효울적인 방법이 됩니다.
'일반상식' 카테고리의 다른 글
| One shot imitation (0) | 2020.03.08 |
|---|---|
| 들여다 본다 (0) | 2020.02.29 |
| Work (0) | 2020.02.09 |
| Top 1000 geniuses (0) | 2020.01.02 |
| 앙투안 라부아지에 (0) | 2020.01.01 |