원본 연구 기사
Ixodes scapularis Symbiont Rickettsia buchneri는 진드기 세포에서 병원성 Rickettsiaceae의 성장을 억제합니다: 벡터 역량에 대한 시사점
- 1 미국 미네소타주 세인트폴 미네소타대학교 식품농업자연자원과학대학 곤충학과
- 2 미국 미네소타주 미네아폴리스 미네소타대학교 공중보건대학원 환경보건학부
Ixodes scapularis 는 북미에서 진드기 매개 병원체의 주요 매개체이지만 특히 병원성 Rickettsia 종을 전염시키지 않습니다. 이 진드기는 I. scapularis 개체군 에 널리 퍼져 있는 transovarially 전송된 endosymbiont Rickettsia buchneri를 품고 있으며, 이는 필수 영양소 제공과 같은 진드기 생존에 대한 선택적 이점을 부여함을 시사합니다. R. buchneri 게놈에는 항생제 합성과 관련된 유전자와 유사한 유전자가 포함되어 있습니다. 다른 Rickettsiaceae에서는 발견되지 않는 2개의 유전자 클러스터가 있으며, 이는 진드기에서 병원성 박테리아를 배제하는 데 관여할 수 있는 가능성을 높입니다. 이 연구는 R. buchneri 가항생제 유전자는 I. scapularis 와 관련된 병원체에 항생제 효과를 발휘할 수 있습니다 . 현저하게 감소된 감염성 및 진드기 매개 병원체 Anaplasma phagocytophilum, R. monacensis 및 R. parkeri의 복제가 R. buchneri를 호스팅하는 IRE11 진드기 세포에서 관찰되었습니다 . 감염 역학을 따르기 위해 형광 플레이트 판독기 분석을 사용하여 낮은 감염률에서도 진드기 세포에 R. buchneri가 존재하면 R. buchneri가 없는 세포 에 비해 R. parkeri 의 성장을 86-100% 억제하는 것으로 나타났습니다. 대조적으로, 낮은 병원성 종 R. amblyomatis 또는 endosymbiont R. peacockii 의 존재R. parkeri 의 감염 및 복제를 부분적으로만 감소시켰습니다 . 숙주 세포가 없는 R. buchneri , R. buchneri 에 감염된 IRE11 의 세포 용해물 또는 R. buchneri 에 감염된 IRE11 배양액의 상청액을 첨가해도 IRE11에서 R. parkeri 감염 및 복제 에 영향을 미치지 않았으며 이러한 처리도 항생제를 나타내지 않았습니다. non-obligate 세포내 박테리아 E. coli 및 S. aureus 에 대한 효과 . 그러나 R. parkeri 로 공격한 R. buchneri 에 감염된 IRE11의 용해물은 R. parkeri 에 대해 약간의 억제 효과를 보였습니다.치료된 IRE11의 감염, 병원성 리케차에 의한 공격이 R. buchneri 의 항생제 효과를 유도할 수 있음을 시사합니다 . 이 연구는 다른 리케차가 I. scapularis를 식민지화 하거나 난소를 통해 전파되는 것을 방지하는 내공생체의 잠재적인 역할을 제안합니다 . 관찰된 억제가 R. buchneri 의 항생제 클러스터 와 연결되어 있다는 확인은 추가 조사가 필요하지만 리케차에 대한 I. scapularis 의 리케차 경쟁 및 벡터 능력을 이해하는 데 중요한 의미를 가질 수 있습니다.
소개
검은다리진드기 Ixodes scapularis Say(Acari: Ixodidae)는 북미에서 인수공통 진드기 매개 병원균의 주요 매개체입니다. 그것은 라임 보렐리아증( Borrelia burgdorferi, Borrelia mayonii ), 인간 아나플라즈마증( Anaplasma phagocytophilum ) 및 인간 바베시아증( Babesia microti ) 을 유발하는 병원균을 포함하여 7가지 병원균을 전염시킵니다 ( 1 ). 흥미롭게도 I. scapularis는 세계 여러 지역에서 사람을 무는 Ixodes 의 다른 주요 종과 달리 병원성 Rickettsia 종을 전염시키지 않습니다 . Ixodes ricinus 및 I. persulcatus, B. burgdorferi, A. phagocytophilum , 진드기 매개 뇌염 바이러스 및 Babesia spp .의 전파를 주로 담당하는 진드기 벡터 . 유럽과 아시아에서는 각각 일반적으로 Rickettsia spp에 감염됩니다. 인간의 질병과 관련이 있습니다. R. helvetica 와 R. monacensis 는 모두 유럽 전역의 I. ricinus 에서 일반적으로 발견되며 ( 2 – 7 ), R. raoultii 및 R. slovaca를 포함하여 주로 다른 진드기 종에 의해 매개되는 다양한 다른 리케차도 다음에서 확인되었습니다. I. 리키누스 ( 3 , 8). 한편, I. persulcatus 는 R. helvetica, R. raoultii, R. sibirica, R. heilongjiangensis 및 " Candidatus R. tarasevichiae"가 종종 이 진드기 종에서 검출되는 더 넓은 범위의 Rickettsia spp. 에 감염됩니다( 3 , 4 , 9 – 15 ). 호주 동부에서 Ixodes holocyclus는 Queensland tick 발진티푸스의 원인균인 R. australis 의 벡터입니다 ( 16 , 17 ).
대신, I. scapularis는 리케차 내공생체 R. buchneri ( 18 )를 호스트하며, 이는 진드기 미생물 군집을 지배하며, 특히 일반적으로 미생물 군집의 거의 100%를 구성하는 암컷에서 그러합니다( 19 – 24 ). 이전에 " I. scapularis 의 리케차 내공생체"(REIS)로 알려진 이 박테리아는 I. scapularis 개체군 전체 에서 발견되었으며 ( 그림 1 ) 높은 유병률을 보이는 경우가 많습니다( 18 – 23 , 25 – 53 ). 진드기와 그 내공생체 사이의 확립된 관계를 암시합니다.Rickettsia buchneri는 침샘에 존재한다는 일부 증거가 있지만( 22 , 52 ) 성인 여성 진드기의 난소에 주로 서식합니다( 18 ). endosymbiont는 transovarially 전송되며 모든 수명 단계에서 발견될 수 있지만( 22 , 26 ) 성인 남성과 미성숙 단계 내에서 어디에 존재하는지 또는 진드기 생물학에서 어떤 역할을 할 수 있는지는 여전히 불분명합니다. 비오틴과 엽산( 54 , 55 )에 대한 완전한 생합성 경로를 암호화하는 내배엽에 있는 유전자의 존재는 혈액에 부족한 필수 영양소를 공급하여 진드기를 도울 수 있음을 시사합니다. 계통 발생 분석은 R. buchneri진드기로 전염되는 Rickettsia 종 의 대부분을 포함하는 SFG(spotted fever group) 리케차(rickettsiae)( 54 )의 조상입니다. R. buchneri 는 I. ricinus 의 R. monacensis 및 Ixodes pacificus 의 rickettsial endosymbiont인 " R. monacensis " 균주 Humboldt( 18 , 56 ) 와 가장 밀접한 관련이 있습니다 . 다른 Rickettsiales와 마찬가지로 SFG rickettsiae는 절대 세포 내 그람 음성 박테리아입니다( 57 ).

그림 1 . 미국의 Ixodes scapularis 에서 R. buchneri 및 "Rickettsial endosymbiont of Ixodes scapularis " 검출 분포 . 음영 영역은 Eisen 및 Eisen( 1 ) 을 기반으로 2016년에 Ixodes scapularis 개체군이 확립된 주를 나타냅니다 . 파란색으로 음영 처리된 상태는 R. buchneri /REIS가 I. scapularis 에서 감지된 상태 입니다 . 카운티 수준 데이터가 있는 레코드는 점으로 표시됩니다. 2007~2021년에 발표된 참고 문헌의 데이터를 기반으로 합니다( 18 – 23 , 25 – 53 ).
SFG 리케차증 사례는 미국에서 증가하고 있습니다( 58 ). R. rickettsii (로키산 홍반열) 감염으로 인한 심각한 질병의 인간 사례는 드문 것으로 보이지만, 주로 다른 덜 병원성이 있는 리케차 종 및 외로운 별 진드기 Amblyomma americanum ( 59 )의 지리적 확장. 이 진드기는 일반적으로 사람을 물고 R. rickettsii ( 60 , 61 )와 R. parkeri ( 62 ) 모두의 잠재적 매개체입니다.), 이는 상대적으로 가벼운 가피 관련 리케차증을 유발합니다( 63 ). 또한 R. amblyommatis는 원래 A. americanum 의 내공생체로 간주되고 이 진드기에서 매우 널리 퍼져 있으며 가벼운 질병( 64 – 66 )과 관련이 있으므로 기여할 수도 있습니다. R. parkeri 의 주요 매개체인 Gulf Coast 진드기 A. maculatum 도 분포를 확대하고 있으며( 67 ), 개체군은 점점 더 미국 북부 지역에서 발견되고 있습니다( 68 , 69 ). I. scapularis 의 분포병원성 SFG Rickettsia spp., 특히 A. americanum 및 Dermacentor variabilis 의 전파에 책임이 있는 진드기 종과 국가의 많은 지역에서 겹칩니다 . 이 진드기는 유사한 서식지와 숙주를 공유할 수 있으므로 I. scapularis가 병원성 Rickettsia 종 과 접촉할 수 있습니다 . 그러나 현장에서 수집된 I. scapularis는 R. buchneri 이외의 Rickettsia 종 에 매우 드물게 감염됩니다 . 이것은 R. buchneri 의 존재가 다른 Rickettsia를 배제하는 역할을 한다는 것을 암시할 수 있습니다.종 틱 호스트에서. 다른 리케차 종 사이의 경쟁(또는 "간섭")의 증거가 다른 진드기에 존재합니다. 예를 들어, Rocky Mountain wood tick Dermacentor andersoni 에 있는 endosymbiont R. peacockii 의 존재는 진드기에서 병원성 R. rickettsii 의 경란성 전파 감소와 관련이 있습니다 ( 70 ). 또한, R. montanensis 또는 R. rhipicephali 로 D. variabilis 를 감염시키면 상호 도전 실험에서 경쟁 리케차의 난소를 통한 전파를 막을 수 있었고( 71 ), A. americanum 에 감염된R. amblyommatis는 감염되지 않은 진드기보다 R. parkeri를 획득할 가능성이 낮았습니다 ( 72 ). 유사하게, R. amblyomatis 에 감염된 A. americanum 유충은 R. rickettsii를 획득할 수 있었지만 , 그 유병률은 R. amblyomatis- free 유충 에 비해 현저히 낮았습니다 ( 73 ). 또한 R. amblyommatis 가 없는 약충에 감염된 기니피그보다 이중 감염된 약충에 의해 R. rickettsii 에 감염된 기니피그 에서 더 가벼운 증상이 관찰되었으며 ( 73 ), R. rickettsii 부하가 추가적인리케차 종. 현장 연구에서 A. maculatum 개체군에서 " Candidatus Rickettsia andeanae" 의 높은 유병률은 이 진드기에서 R. parkeri가 제외되는 것과 관련이 있다고 가정했습니다 ( 74 ). Rickettsia 종 사이의 경쟁 메커니즘 또는 이것이 내부 공생 종과 병원성 종에 대해 다를 수 있는지 여부는 해명되지 않았습니다.
R. buchneri 의 두 가지 게놈 서열이 현재 이용 가능합니다. REIS(Wikel) 게놈은 Wikel 콜로니( 54 )의 I. scapularis 의 게놈 서열에서 추출되었으며 , R. buchneri ISO7 T 게놈은 암컷 I 의 난소에서 분리된 R. buchneri 유형 균주 로부터 시퀀싱되었습니다. . 미네소타의 개에게서 제거된 견갑골( 18 ). 아미노글리코사이드 항생제 생합성 기구를 코딩하는 유전자 클러스터는 R. buchneri 에서 확인되었으며 ( 54 ), 이는 다른 리케차에는 존재하지 않으므로 항생제 생산은 다음과 같은 메커니즘을 나타낼 수 있습니다.R. buchneri는 I. scapularis 에서 병원성 Rickettsia 종을 배제할 수 있습니다 . 클러스터의 유전자는 Actinobacteria 및 Firmicutes 구성원에서 발견되는 kanamycin 및 gentamicin 합성 유전자 클러스터의 유전자와 매우 유사한 것으로 밝혀졌지만( 54 ), 아직까지 이러한 유전자가 R. buchneri 에서 기능하는지 여부를 조사한 실험 연구는 없습니다 . 이 연구에서 우리는 Gillespie et al.에 의해 기술된 것과 거의 동일한 aminoglycoside 생합성 유전자 클러스터를 보고합니다. ( 54 ), R. buchneri ISO7 T 에도 존재합니다.REIS(Wikel) 게놈에 부분적으로만 존재하는 것으로 보이는 폴리케타이드 및 비리보솜 펩티드 항생제 합성에 대한 유전자와 유사한 유전자를 암호화하는 두 번째 유전자 클러스터와 함께 게놈. 또한, 이 연구는 이러한 클러스터의 유전자가 활발하게 전사되고 R. buchneri 와 진드기와 관련된 리케차 병원체 사이에 경쟁이 존재하는지 여부를 시험관 내 실험을 사용하여 진드기 세포에서 내배엽의 존재가 억제 효과가 있다는 예비 증거를 제공한다는 것을 보여줍니다. 다른 세포내 박테리아의 감염 및 복제에 대해.
재료 및 방법
Rickettsia buchneri 항생제 유전자 클러스터 의 생물정보학적 분석
시퀀싱된 R. buchneri ISO7 T 게놈 의 주석 [GenBank: JFKF01000000.1; ( 18 )] aminoglycoside, polyketide 및 non-ribosomal peptide 합성에 대한 박테리아 유전자와 유사한 두 개의 유전자 클러스터의 존재를 확인했습니다. R. buchneri 의 이 변종은 미네소타의 개에서 채취한 I. scapularis 암컷 의 난소에서 분리되었습니다 ( 18 ). 추정되는 두 항생제 클러스터에서 단백질의 잠재적인 기능을 결정하기 위해 R. buchneri ISO7 T 의 아미노산 서열기본 매개변수로 수행된 NCBI 단백질-단백질 BLAST 알고리즘을 사용하여 다른 사용 가능한 서열에 대해 게놈을 검색했습니다. InterPro 데이터베이스의 각 단백질에 대한 데이터를 조사하고 문헌 검색을 수행하여 추정 단백질 기능을 결정했습니다. 유전자 클러스터는 또한 I. scapularis 게놈 서열 , REIS(Wikel)[GenBank: CM000770.1; ( 54 )]. 주석이 달린 게놈에서 얻은 단백질 서열은 MacVector 버전 18.1.5에서 ClustalW( 75 ) 및 MUSCLE( 76 ) 을 사용하여 정렬되었습니다 .
세포 및 리케차 배양
배아 진드기 세포주 ISE6( 77 ), IRE11( 78 ) 및 AAE2( 79 )는 각각 I. scapularis, I. ricinus 및 A. americanum 에서 파생되었으며 5%가 보충된 L15C300 배지에서 34°C로 유지되었습니다. 열 불활성화 태아 소 혈청(FBS), 5% 트립토오스 인산염 국물(TPB) 및 0.1% 지단백 농축액(LPC; MP Biomedicals, Irvine, CA, USA), 이전과 같이 1M NaOH로 pH 7.2-7.5로 조정 설명 ( 77 ). Rickettsia buchneri ISO7 T [( 18 ); 이하 Rb- WT 라고 함 ] 및 플라스미드 pRAM18dRGA로부터 GFPuv를 발현하는 R. buchneri [(80 ); 이하 Rb- GFPuv 로 지칭됨 ]은 10% FBS, 5% TPB, 0.06% NaHCO 3 , 6mM HEPES 및 0.1% LPC를 함유하는 변형된 L15C300 배지에서 28℃의 IRE11에서 유지되었고; pH는 조정하지 않았습니다. 플라스미드 pRAM18dSFA( Rp- mKate)( 80 , 81 ) 로부터 mKate를 발현하는 Rickettsia parkeri Tate's Hell , R. peacockii- GFPuv[pRAM18dSGK; ( 80 )], R. monacensis IrR/Munich with mKate (pRAM18dSFA), 및 A. phagocytophilum HGE1 유전자간 Himar1 트랜스포존 삽입으로부터 mCherry를 발현합니다 ( 82 ) ( A. phagocytophilum-mCherry)는 ISE6 세포에서 성장했고, R. amblyomatis Darkwater(Chris Paddock, CDC에서 제공)는 AAE2 세포에서 성장했습니다. 감염된 진드기 세포 배양액은 pH 7.5로 조정된 10% FBS, 5% TPB, 0.1% LPC, 0.25% NaHCO 3 및 25mM HEPES가 포함된 L15C300에서 34°C로 유지되었습니다( 83 ). 세포 배양의 감염 수준은 Giemsa 염색으로 평가했습니다. Vero 세포(아프리카 녹색 원숭이 신장)는 확립된 방법에 따라 34°C에서 10% FBS 및 2mM L-글루타민이 보충된 Gibco RPMI 1640(Thermo Fisher, Waltham, MA, USA)에서 성장했습니다( 84 ) . 모든 배양물은 25-cm 2 배양 플라스크(CELLSTAR, Greiner Bio-One, Monroe, NC, USA) 에서 성장시켰다 .
숙주 무세포 박테리아는 이전에 설명한 대로 준비했습니다( 83 ). 심하게 감염된 진드기 세포를 락 텀블러 그릿(60/90 거친 실리콘 카바이드, Lortone, Mukilteo, WA, USA)이 들어 있는 튜브에 첨가하고 30초 동안 와류 처리한 다음 2μm 필터를 통과시켜 세포 파편을 제거했습니다. 그런 다음 무세포 박테리아를 4°C에서 5분 동안 13,200 x g에서 원심분리하여 수집했습니다.
역전사 효소 PCR
무세포 Rb-WT는 위에서 설명한대로 감염된 IRE11 문화에서 준비되었습니다. 박테리아 펠렛을 SPG 완충액으로 1회 세척한 다음, 1 ml TRI 시약(Sigma-Aldrich, St Louis, MO, USA)에 재현탁하고, 볼텍싱하고, 실온에서 10분 동안 휴지시켰다. 샘플을 12,000 x g에서 원심분리하여 미립자를 제거하고 상등액을 새 튜브로 옮기고 100% 에탄올과 1:2로 혼합한 다음 볼텍싱했습니다. RNA는 Direct-zol RNA Miniprep Kit(Zymo Research, Irvine, CA, USA)를 사용하여 정제했습니다. 오염된 DNA는 Ambion TURBO DNA-free Kit(Thermo Fisher)로 3회 처리한 후 RNA Clean & Concentrator Kit(Zymo Research)로 정제하여 제거했습니다. 역전사효소 PCR(RT-PCR)은 Access RT-PCR 시스템(Promega, Madison, WI, USA)을 사용하여 5× 반응 완충액, 10μM dNTP, 각 프라이머 10μM, Tf1 DNA 폴리머라제 0.5μl, 뉴클레아제 없는 물 14.5μl 및 샘플 1μl. 뉴클레아제가 없는 물을 음성 대조군으로 사용하였고 역전사효소가 없는(no RT) 대조군에는 DNA 중합효소 대신 물이 포함되어 DNA 오염이 없음을 확인했습니다. RT-PCR은 Techne TC-312 Thermocycler에서 다음과 같은 순환 조건으로 수행되었습니다: 45°C에서 45분; 94°C에서 2분; 94°C에서 30초, 55°C 또는 58°C에서 1분, 68°C에서 2분의 40주기; 최종 연장 68°C에서 1분. 증폭 RT-PCR은 Techne TC-312 Thermocycler에서 다음과 같은 순환 조건으로 수행되었습니다: 45°C에서 45분; 94°C에서 2분; 94°C에서 30초, 55°C 또는 58°C에서 1분, 68°C에서 2분의 40주기; 최종 연장 68°C에서 1분. 증폭 RT-PCR은 Techne TC-312 Thermocycler에서 다음과 같은 순환 조건으로 수행되었습니다: 45°C에서 45분; 94°C에서 2분; 94°C에서 30초, 55°C 또는 58°C에서 1분, 68°C에서 2분의 40주기; 최종 연장 68°C에서 1분. 증폭HTH, lagD, ppsE_1, kanC 및 btrB 는 어닐링 온도 58℃, 글리코겐 신타제, 호모세린 키나아제 및 lg rB 의 증폭은 55℃에서 수행 하였다 . 이 연구에 사용된 프라이머는 표 1 에 나와 있습니다 . RT-PCR 산물은 GelGreen(Biotium, Fremont, CA, USA)으로 염색된 1.2% 아가로스 젤에서 가시화되었습니다.

표 1 Rickettsia buchneri 항생제 클러스터 유전자 의 증폭에 사용되는 프라이머 .
시험관 내 경쟁 검정
Rb- GFPuv 감염이 있거나 없는 진드기 세포에서 R. monacensis- mKate, Rp- mKate 및 A. phagocytophilum- mCherry 의 감염 및 복제를 비교하기 위해 경쟁 분석을 24-웰 플레이트에 설정했습니다 . R. monacensis 및 R. parkeri 실험을 위해 3개의 24웰 플레이트를 준비했습니다. 첫 번째는 감염되지 않은 IRE11을 포함했고, 두 번째는 Rb -GFPuv에 심하게 감염된 IRE11을 포함했으며, 세 번째는 대략 45%의 Rb- GFPuv 감염 수준을 제공하기 위해 감염된 세포와 감염되지 않은 세포의 혼합물을 포함했습니다 . 세포(0.4 ml)를 각 웰에 적용하여 1 x 10 6 세포/웰을 제공했습니다.R. monacensis 실험 또는 R. parkeri 실험에서 3 × 10 5 세포/웰 . 플레이트를 28°C에서 습한 양초 단지에서 배양했습니다. 24시간 후, 플레이트를 숙주 세포가 없는 R. monacensis- mKate 또는 Rp-mKate, 10배 연속 희석. 각 희석액을 각 플레이트에 3회 적용하고 나머지 웰을 음성 대조군으로 사용했습니다. 최저 희석 웰에서 mKate-양성 콜로니의 수는 형광 현미경에 의해 결정되었고 각 희석에서 리케차의 수를 추정하는 데 사용되었습니다. Nikon Diaphot 형광 현미경에서 웰을 관찰하고 14일 동안 적색 형광 리케차를 시각화하여 각 플레이트의 각 희석액에 대한 접착/침입 및 복제를 결정했습니다. 추가로, IRE11을 감염시키는 Rp -mKate 의 능력을 웰당 적어도 500개의 세포를 관찰하고 복제 형광 R. 파케리를 함유하는 세포의 백분율을 결정함으로써 14일 동안 매일 평가하였다 .
A. phagocytophilum 실험을 위해 5개의 24웰 플레이트를 준비했습니다. 2개는 감염되지 않은 IRE11을 함유하고, 2개는 Rb -GFPuv 에 심하게 감염된 IRE11을 함유하고 , 다섯 번째는 대략 25%의 Rb- GFPuv 감염 수준을 제공하기 위해 감염된 세포와 감염되지 않은 세포의 혼합물을 함유했습니다 . 세포(0.5 ml)를 각 웰에 적용하여 1 x 10 6 세포/웰을 얻었다 . 감염되지 않은 IRE11 플레이트 1개와 감염된 IRE11 플레이트 1개를 가습 양초병에서 27°C로 배양했습니다. 나머지 3개의 플레이트는 4% CO 2 와 함께 34°C에서 배양되었습니다 . 24시간 후, 플레이트를 숙주 세포가 없는 A. phagocytophilum 의 10배 연속 희석액을 포함하는 250 μl 배지로 감염시켰습니다.- mCherry, 3중으로 플레이트에 추가됨. 각 희석액의 Anaplasma 수는 ISE6 세포가 주입된 여섯 번째 24웰 플레이트에서 각 희석액을 테스트하고 가장 낮은 희석액 웰에서 mCherry 양성 콜로니의 수를 계산한 다음 각 희석액으로 외삽하여 추정했습니다. Nikon Diaphot 형광 현미경에서 웰을 관찰하고 적색 형광 박테리아의 시각화를 통해 각 플레이트의 각 희석액에 대한 부착/침입 및 복제를 결정했습니다.
형광판 판독기 어세이
IRE11 세포에서 형광 Rickettsia 의 성장 역학을 측정하기 위해 형광 플레이트 판독기 분석을 사용했습니다 . 감염되지 않은 IRE11 및 Rb- GFPuv로 심하게 감염된 IRE11(>95% 세포 감염)을 신선한 10% FBS 배지에서 1 x 10 5 세포/ml로 조정했습니다. 심하게 감염된 세포와 감염되지 않은 세포를 혼합하여 25%, 50% 및 75% 감염된 세포로 추가 집단을 생성했습니다( 그림 2 ). 각 세포 집단의 부피 200 μl를 바닥이 투명한 흑색면 96-웰 플레이트(Falcon, Corning, NY, USA)의 웰에 3중으로 첨가하고, 건조를 방지하기 위해 웰 사이에 dH 2 O를 첨가하고, 인큐베이션 하였다 . 세포가 웰의 바닥에 정착할 수 있도록 24시간 동안 28°C의 가습된 양초 단지에서. 숙주 세포 없음Rp- mKate를 1ml의 신선한 배지에 재현탁하고 Petroff-Hausser 챔버에서 계수했습니다. 무세포 박테리아를 희석하여 1,000:1, 100:1 및 10:1 감염 다중도(MOI) 비율을 만든 다음 96-웰 플레이트의 IRE11 세포에 10μl의 부피로 첨가했습니다. 플레이트를 가습된 양초 단지에 다시 넣고 28°C에서 배양했습니다. 형광 판독값은 감염 후 24시간 후에, 그 다음에는 24시간마다 최대 14일까지 측정되었습니다. GFPuv의 경우 여기/방출 395/509, mKate의 경우 588/633에서 BioTek Synergy H1 마이크로플레이트 판독기에서 실온(~22–25°C)에서 판독값을 얻었고 배경 형광을 설명하기 위해 감염되지 않은 IRE11로 조정했습니다.
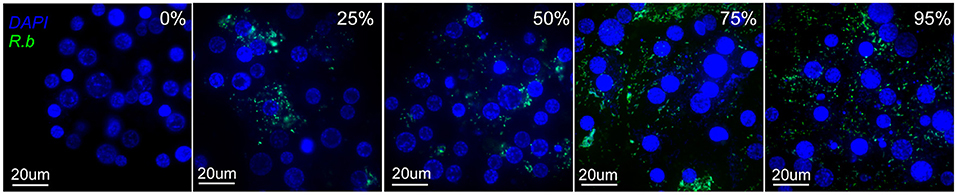
그림 2 . R. buchneri- GFPuv 감염 수준이 다른 IRE11 세포의 이미지 . 살아있는 IRE11 세포를 NucBlue Live ReadyProbes 시약(Hoechst 33342; Invitrogen)으로 염색하고 Wang et al. ( 81 ). ×60 대물렌즈와 이중 파장 필터(DAPI; FITC)를 사용하여 Olympus BX61 DSU 공초점 현미경으로 이미지를 캡처했습니다. 파란색으로 표시된 DNA, 녹색으로 표시된 GFPuv.
R. amblyommatis 에 대한 플레이트 판독기 실험은 감염되지 않은 25% 및 >95% 감염된 세포 집단만 사용하고 1,000:1 및 10:1 Rp- mKate 챌린지만 수행한 것을 제외하고 위와 유사한 프로토콜을 사용했습니다. 또한 이러한 실험에서는 mKate 형광만 측정했습니다. R. peacockii 실험은 Rb- GFPuv 와 동일한 프로토콜을 사용하여 수행되었습니다 . IRE11 플레이트 실험에 앞서 무세포 R. amblyommatis 및 R. peacockii (각각 AAE2 및 ISE6 세포에서 성장)를 IRE11로 옮기고 변형된 L15C300 배지에서 28°C에서 최소 2주 동안 배양하여 성장에 맞게 조정했습니다. 이러한 조건에서. 둘 다 리케차종은 IRE11 세포에서 잘 자라는 것으로 밝혀졌습니다.
무세포 R. buchneri 및 R. buchneri 의 용해물이 Rp- mKate 의 복제에 미치는 영향을 평가하기 위해 , 96-웰 플레이트에 감염되지 않은 IRE11 200 μl를 1 x 10 5 세포/ml 로 조정했습니다. 위와 같이 중간. 세포를 50 μl 배지(음성 대조군), 2.5 × 10 5 심하게 감염된 IRE11 로부터 제조된 50 μl의 무세포 Rb - WT , 50 μl의 무세포 Rb - WT의 1:10 희석액, 50 μl 로 처리하였다. Rb- WT 에 심하게 감염된 2.5 × 10 5 IRE11 의 μl 세포 용해물 또는 2.5 × 10 5 의 50 μl 세포 용해물감염되지 않은 IRE11. 총 1분 동안 얼음 위에서 세포를 최대 전력으로 초음파 처리하여 용해물을 준비했습니다(3 x 20초 버스트로 분리, 20초 간격으로 얼음 위에 놓음). 2시간 후 세포에 무세포 Rp- mKate를 1,000:1, 100:1 또는 10:1로 챌린지하고 플레이트를 28°C의 가습 양초병에서 배양했습니다. mKate 형광은 위에서 설명한 대로 14일 동안 24시간마다 측정하고 감염되지 않은 미처리 IRE11로 조정했습니다.
R. parkeri가 R. buchneri 항생 활성을 유도할 수 있는지 확인하기 위해 , 다양한 시간 동안 R. buchneri 로 챌린지된 R. buchneri의 용해물이 Rp - mKate 의 성장에 대한 억제 효과를 나타내는 지 여부를 조사하기 위해 추가 플레이트 판독기 분석을 사용했습니다. IRE11 세포. 6-웰 플레이트의 웰에 Rb -WT로 75% 감염된 2 ml IRE11을 1 x 10 5 /ml로 시딩하였다. 하나의 웰은 무챌린지 대조군 역할을 한 반면, 나머지 웰에는 무세포 Rp-100:1 비율의 mKate가 추가되었습니다. 플레이트를 28°C의 양초 단지에서 배양했습니다. 24시간 후, 대조군과 챌린지된 웰 중 하나의 세포를 수집하고 위와 같이 IRE11에서 리케차를 분리했습니다. 그런 다음 세포 펠릿을 -70°C에서 동결했습니다. 감염 후 48, 72, 120 및 168시간에 나머지 각 웰의 세포에 대해 이를 반복했습니다. 용해물은 -70 ~ 37°C의 4회 동결 해동 주기에 의해 펠렛으로부터 준비되었습니다. 각 처리에서 얻은 리케차 용해물을 120μl 배지에 재현탁한 다음 10μl를 96-웰 플레이트의 12개 웰에 첨가했습니다. 각 웰은 24시간 전에 준비한 1 x 10 5 /ml의 200μl IRE11을 포함합니다. 그런 다음 웰에 Rp- mKate를 1,000:1, 100:1 및 10:1의 비율로 챌린지했습니다 . Rp- 없이 중간mKate를 추가하여 각 처리에 대한 웰을 제어했습니다. 플레이트를 28°C의 습한 양초 단지에서 배양하고 mKate 형광을 위에서 설명한 대로 14일 동안 24시간마다 측정했습니다.
항생제 감수성 분석
세포외세균에 대한 R. buchneri 의 항생제 활성을 시험하기 위해 디스크 확산 분석법을 사용하여 Escherichia coli D21 및 Staphylococcus aureus MN8 에 대한 항생제 감수성 시험을 수행하였다 . Rb- WT 로 감염된 IRE11 과 감염되지 않은 IRE11을 4°C에서 6분 동안 350 x g 에서 원심분리하여 펠릿화 하고 펠릿을 -70°C에서 동결했습니다. 무세포 Rb- WT는 위에서 설명한 대로 텀블러 그릿으로 볼텍싱하고 2μm 필터를 통해 여과하여 준비한 다음 박테리아를 13,600 x g 에서 원심분리하여 펠릿화했습니다.4°C에서 7분 동안 처리하고 세포 펠렛을 -70°C에서 동결합니다. 3개 시료의 용해물은 동결-해동(-70 ~ 37°C의 4주기) 후 4°C에서 5분 동안 13,600 × g 에서 원심분리하여 준비했습니다. 박테리아 또는 세포 용해물을 50 μl 배지에 재현탁하고, 그 중 30 μl를 50 μl 무수 메탄올에 첨가했습니다. 그런 다음 각 샘플 20μl의 부피를 별도의 여과지 디스크에 추가했습니다. 10 및 100㎍의 스펙티노마이신을 양성 대조군으로서 2개의 추가 여과지 디스크에 첨가하였다. 디스크를 생물안전성 캐비닛에서 20-30분 동안 공기 건조시킨 다음 E. coli D21 또는 S. aureus MN8이 줄무늬가 있는 Mueller-Hinton 한천 플레이트에 놓았습니다. 플레이트를 37°C에서 18시간 동안 배양했습니다.
살아있는 IRE11, Rb- WT에 감염된 IRE11(25%, 50% 및 >95% 감염) 및 무세포 Rb- WT의 펠릿과 다양한 수준의 IRE11 배양액의 상청액을 사용하여 디스크 확산 분석을 반복했습니다. Rb- WT 감염 (25, 50, >95%) 또는 감염되지 않음. 세포 를 12°C에서 6분 동안 350 x g 에서 원심분리하여 펠렛 화하고, 상청액을 분리된 튜브로 제거한 다음 펠렛을 100 μl 배지에 재현탁했습니다. 재현탁된 세포 펠릿 20μl 또는 상청액 20μl를 여과지 디스크에 첨가했습니다. Spectinomycin은 양성 대조군을 위해 100 μg의 추가 디스크에 추가되었습니다. 디스크를 생물안전성 캐비닛에서 20-30분 동안 공기 건조시킨 다음 E. coli 줄무늬가 있는 Mueller-Hinton 한천 플레이트에 적용했습니다.D21 또는 S. 아우레우스 MN8. 플레이트를 37°C에서 18시간 동안 배양했습니다.
포유동물 세포에서 성장한 R. parkeri 에 대한 Rb- WT-감염 IRE11 배양물 로부터의 상청액 의 항생제 활성을 추가로 시험하기 위해 , Vero 세포 배양물을 감염되지 않은 IRE11 또는 IRE11로부터의 2.5ml 상청액이 보충된 2.5ml RPMI 배지에서 34℃에서 성장시켰다. Rb- WT 에 심하게 감염됨 . 무세포 Rp- mKate를 Vero 배양에 첨가하고 플라스 크를 감염의 증거가 있는지 매일 확인했습니다. 플라크의 시기와 크기뿐만 아니라 세포층의 플라크 모양으로 평가했습니다.
R. parkeri 공격 에 대한 항생제 유전자의 발현
Rb- WT에 의한 항생 유전자의 발현이 R. parkeri 에 의한 공격에 의해 유도되었는지 여부를 결정 하고 최대 발현 시간을 결정하기 위해, 도전되지 않은 것과 Rp -mKate에 감염된 Rb -WT에 감염된 것을 비교하는 시간 경과 실험을 설정했습니다. IRE11. 2ml 변형된 L15C300 배지에서 1 x 10 5 /ml의 Rb- WT 로 감염된 IRE11 75%를 함유하는 각 웰로 6-웰 플레이트를 제조하였다 . 1개의 웰은 챌린지 없는 대조군 역할을 하고 나머지 웰에는 무세포 Rp -mKate를 10μl당 100:1의 비율로 첨가했습니다. 플레이트를 28°C의 양초 단지에서 배양했습니다. 24시간 후, 대조군 웰로부터 세포를 수집하고 500×에서 2분 동안 원심분리하였다.g , 그리고 세포 펠릿을 750 μl RNAlater 용액(Qiagen, Hilden, Germany)에 재현탁하고 -20°C에서 보관했습니다. 챌린지 웰의 세포를 감염 후 24, 48, 72, 120 및 168시간에 수집하여 RNAlater 용액에 재현탁하고 -20°C에서 보관했습니다. TRIzol-클로로포름 추출을 사용하여 RNA 분리를 수행했습니다. 오염된 DNA를 제거하기 위해 상온에서 gDNA 지우개로 30분 처리한 후 Takara RT PrimeScript Kit(Takara Bio, Kusatsu, Japan)를 사용하여 cDNA를 준비했습니다. 정량적 PCR(qPCR)은 Agilent Brilliant II SYBR Green Master Mix를 사용하여 Agilent Mx3005P RT-PCR 시스템에서 수행되었으며, 두 유전자 클러스터( 표 1 ) 및 1μl cDNA 준비 에서 다양한 표적에 대한 10μM 프라이머를 사용했습니다. R. buchneri 와R. parkeri가 샘플에 존재했고, I. scapularis GAPDH가 참조 유전자로 사용되었습니다. 뉴클레아제가 없는 물과 역전사효소 컨트롤이 각 플레이트에 포함되지 않았습니다. 각 샘플은 3회 실행되었습니다. 순환 조건은 95°C에서 10분, 이어서 95°C에서 30초, 55°C( glycogen synthase, GAPDH ) 또는 52°C( btrB, kanC, lgrE, ppsE_1 )에서 1분의 40주기였습니다. 72°C에서 최소 결과를 GAPDH 발현 과 비교하여 샘플당 총 cDNA를 조정했습니다. 프라이머 효율을 측정하기 위해 R. buchneri 의 cDNA로 구성된 표준 곡선-감염된 IRE11도 반응 플레이트에 추가되었습니다. 프라이머 효율의 차이를 설명하기 위해 PCR 효율 보정으로 상대 정량을 계산했습니다( 85 ).
통계 분석
모든 통계 분석은 GraphPad Prism 버전 9.1.2를 사용하여 수행되었습니다. 플레이트 판독기 실험의 경우, 다른 Rickettsia 로 감염되거나 용해물로 처리된 IRE11 배양에서 Rp- mKate 의 성장은 대조군으로 감염되지 않은 IRE11 웰에서 Rp- mKate 성장 을 사용하여 Dunnett의 다중 비교 테스트와 양방향 ANOVA를 사용하여 분석되었습니다 . 상대 유전자 발현을 Dunnett's multiple-comparison test와 양방향 ANOVA로 분석하여, Rp- 챌린지 그룹의 발현을 챌린지 안된 대조군 그룹의 발현과 비교했습니다. 통계적 유의성은 p < 0.05 일 때 지정되었습니다 .
결과
Rickettsia buchneri 의 항생제 유전자 군집의 기술 및 발현
시퀀싱된 R. buchneri ISO7 T 게놈을 분석한 결과 항생제 합성에 관여하는 것과 유사한 단백질을 암호화하는 두 개의 유전자 클러스터가 포함되어 있음이 밝혀졌습니다. Rickettsiaceae 의 다른 구성원에는 두 유전자 클러스터가 모두 존재하지 않습니다 . 첫 번째 클러스터는 폴리케타이드 및 기타 비리보솜 펩타이드 합성 효소에 대한 유전자를 포함하여 11개의 유전자를 포함합니다( 표 2 , 그림 3A ). 이러한 화합물(페니실린, 사이클로스포린 A, 반코마이신 및 에리트로마이신 포함)의 생합성 경로는 사슬 연장 및 변형 추가의 촉매 작용 을 위한 조립 라인 역할을 하는 대규모 다중 모듈 효소를 포함합니다.). 이들은 일반적으로 예를 들어 메틸화 또는 고리화에 의해 및/또는 조립 라인에서 방출함으로써 생성된 화합물을 추가로 변형시키는 맞춤 효소를 암호화하는 추가 유전자와 함께 클러스터링됩니다( 87 , 88 ). R. buchneri polyketide 클러스터 의 단백질은 Gammaproteobacteria Legionella israelensis, Erwinia amylovora, Pantoea ananatis 및 Pectobacterium spp.의 서열과 유사성을 나타냅니다. 뿐만 아니라 시아노박테리아( 보충 그림 S1 , 보충 데이터 S1 ). 흥미롭게도, 클러스터의 가상 단백질 중 하나는 유형 IV 필린인 것으로 보이며, 그의 시퀀스는 두 개에서 나온 것을 제외하고 블래스트 히트를 얻지 못했습니다.R. buchneri 게놈. 클러스터의 처음 세 유전자만 REIS(Wikel) 게놈에 보존되고 나머지 유전자는 존재하지 않습니다( 그림 3A , 표 2 , 보충 그림 S1 ). 대신, ppsE_1 하류의 REIS 게놈 영역은 수많은 tra 유전자를 암호화합니다(REIS_1815 = traC , REIS_1814 = traV , REIS_1813 = 절단된 traB , REIS_1810 = traE ). 클러스터의 업스트림 영역은 유사한 유전자 배열을 가진 두 게놈에서 상동입니다( 그림 3A ). 흥미롭게도 Rb 에서 ysdC를 따르는 유전자는ISO7 게놈은 REIS 게놈의 다른 영역에 있는 것과 상동이며, ysdC 다음 유전자인 REISMN_1205는 REIS_1393과 동일합니다( 그림 3A ). 특히 REIS_1393의 업스트림 영역은 트랜스포사제 서열로 많이 채워져 있으며, 이는 트랜스포지션 이벤트가 REIS 게놈에서 나머지 폴리케타이드 클러스터 유전자의 손실로 이어질 수 있음을 시사합니다.
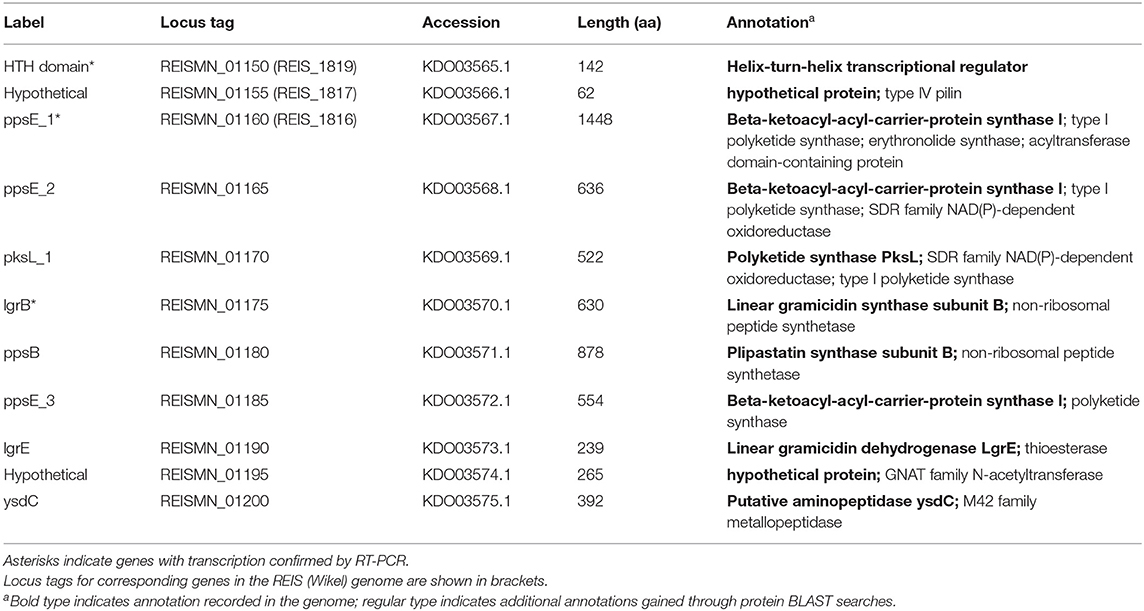
표 2 Rickettsia buchneri 추정 폴리케타이드 합성 클러스터 의 유전자 .
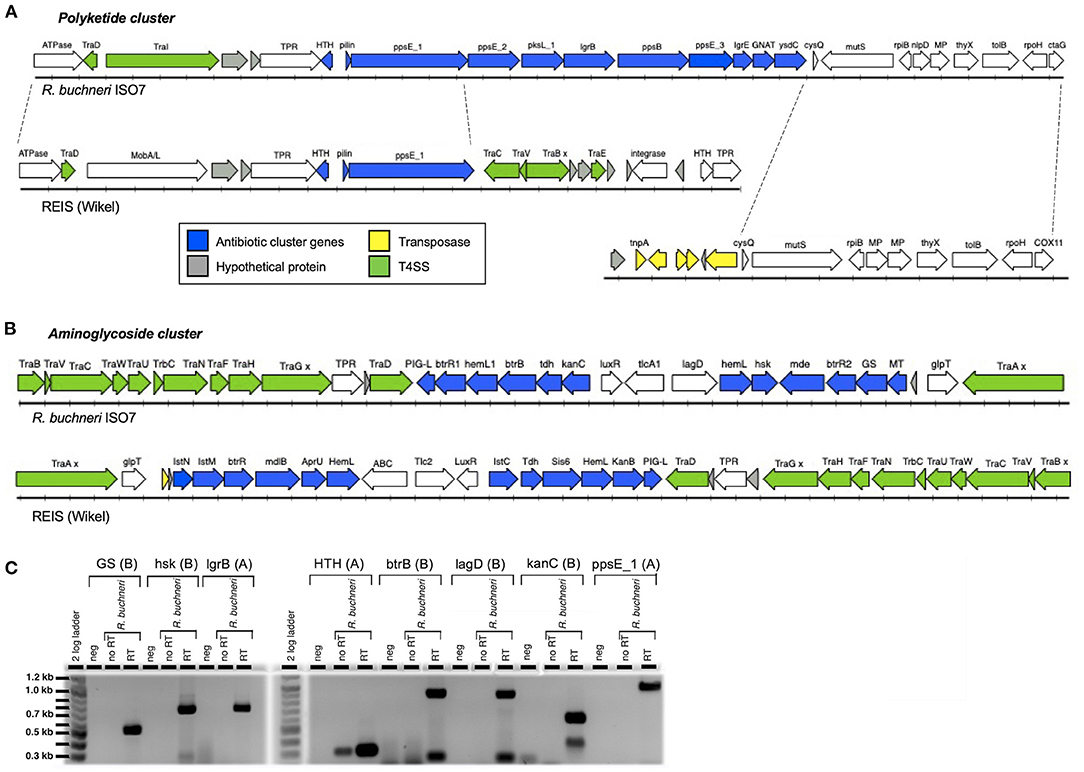
그림 3 . Rickettsia buchneri 의 항생제 유전자 클러스터 . 폴리케타이드 (A) 및 아미노글리코사이드 (B) 합성 유전자를 포함하는 R. buchneri ISO7 항생제 유전자 클러스터 의 유전자 배열과 게놈의 인접 영역 및 REIS(Wikel) 게놈과의 비교를 보여주는 다이어그램 . GS - 글리코겐 합성효소; hsk - 호모세린 키나제; MT - 메틸트랜스퍼라제; MP - 메탈로펩티다아제; x는 잘림을 초래하는 돌연변이를 나타냅니다. (C) R. buchneri ISO7 RNA 의 RT-PCR은 항생제 클러스터에서 선택된 유전자의 전사를 보여줍니다. 유전자 산물 및 항생제 클러스터(A = 폴리케타이드, B = 아미노글리코사이드)는 겔의 웰 위에 표시됩니다. 보다추가 정보는 표 2 , 3 을 참조하십시오.
Gillespiet al. ( 54 ) 또한 추정되는 프레임 이동 돌연변이(REIS_0330)가 있는 추가 폴리케타이드 신타제를 확인했습니다. 이것은 추가적인 폴리케타이드 신타제 유전자에 대한 Rb ISO7 게놈 의 검사를 촉발시켰다 . 3개의 클러스터가 식별되었으며 pksL_2 (REISMN_07055), pksR (REISMN_07060) 및 pksN (REISMN_07065)으로 주석이 지정됩니다. 동일한 단백질을 암호화하는 해당 유전자는 GenBank의 REIS(Wikel) RefSeq에 각각 해당 위치 태그 REIS_RS15050(가상 단백질), REIS_RS10770(메틸트랜스퍼라제) 및 REIS_RS01405(KR 도메인 함유 단백질)가 있는 주석이 추가됩니다.
두 번째 클러스터에는 15개의 유전자가 포함되어 있으며, 11개는 아미노글리코시드 항생제 합성에 관여하는 유전자와 유사성을 나타내며, 추정되는 항생제 수출자 및 항생제 내성 인자를 코딩하는 유전자를 포함합니다( 표 3 , 그림 3B ). 이 두 번째 항생제 클러스터는 REIS(Wikel) 게놈( 54 )에서도 확인되었으며 Rickettsiales 증폭 유전 요소인 RAGE-A와 관련이 있는 것으로 밝혀졌습니다 . 아미노글리코사이드계 항생제에는 스트렙토마이신, 카나마이신 및 겐타마이신이 포함되며 많은 효소 반응을 포함하는 복잡한 생합성 경로를 통해 생산됩니다. 이러한 경로 중 일부는 완전히 특성화되었습니다( 89 – 91 ). R. buchneri 의 단백질아미노글리코사이드 클러스터는 Actinobacteria 및 Firmicutes의 항생제 합성 유전자 클러스터의 클러스터와 유사성을 보이는 반면( 54 ), 추정되는 다중약물 수출체 mde/mdlB, 전사 조절인자 LuxR 및 ABC 수송체 lagD는 Gammaproteobacteria의 단백질과 더 큰 유사성을 보입니다(보충 그림 S2, 보충 그림 S2, 보충 그림 S2 , 보충 그림 데이터 S2 ). 한편, 뉴클레오타이드 전좌효소 tlcA1/tlc2는 다른 Rickettsia 종의 것과 관련이 있습니다( 54 ). 이 클러스터는 두 R. buchneri 게놈( 그림 3B , 표 3 ) 에서 보존되며 대부분의 시퀀스는 동일합니다( 보충 그림 S2 ).
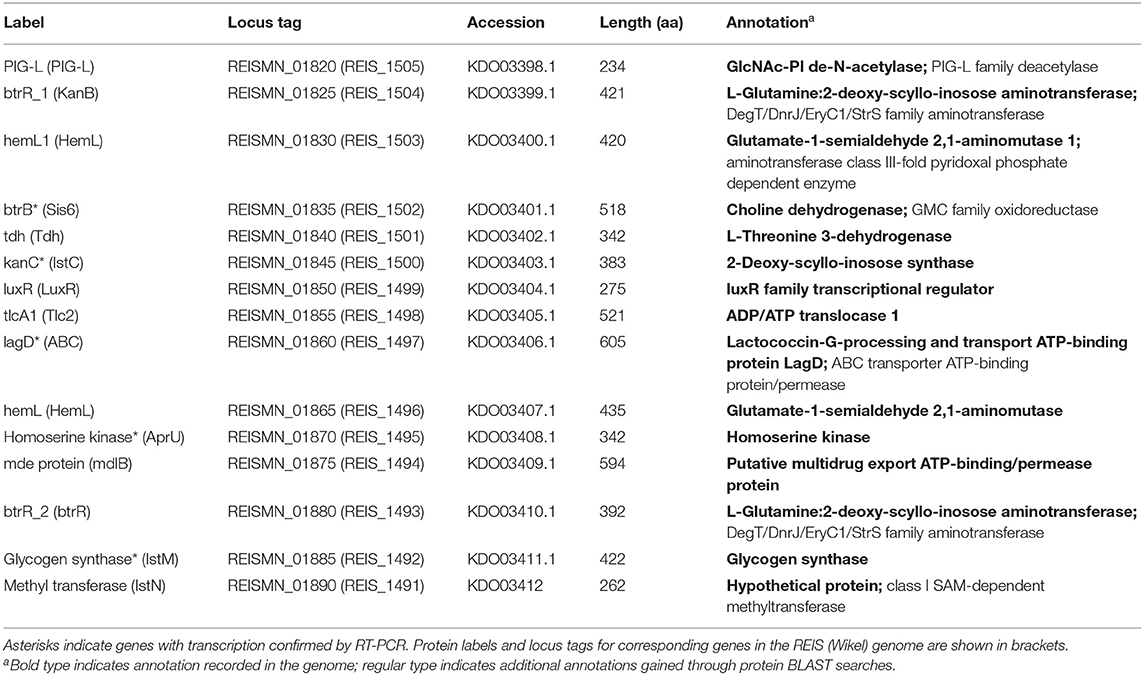
표 3 . Rickettsia buchneri 추정 아미노글리코사이드 합성 클러스터 의 유전자 .
이들 유전자가 R. buchneri 에 의해 능동적으로 전사되는지 여부를 결정하기 위해 , RT-PCR 분석을 위해 2개의 항생제 클러스터로부터 8개의 유전자를 선택하였다( 표 2 , 3 ). 겔 전기영동에서 관찰된 예상 크기의 밴드로 표시된 바와 같이 8개 유전자 모두에 대한 전사물이 검출되었습니다( 도 3C ). 음성 대조군 및 무 RT 대조군은 생성물을 나타내지 않았 으며, 덜 강력한 밴드가 보이는 HTH 를 제외하고는 RT 웰보다 증폭이 분명히 덜하지만 약간의 DNA 오염을 암시합니다. btrB, lagD 및 kanC 반응 에서 관찰되는 더 작은 밴드는 비특이적 생성물을 나타내는 것 같습니다.
체외 항생제 실험
R. buchneri가 진드기 세포를 감염시키는 다른 박테리아에 대해 항생 작용을 나타낼 수 있는지 여부를 결정하기 위해 무세포 적색 형광 A. phagocytophilum, R. monacensis 또는 R. parkeri 를 사용하여 다양한 수준의 녹색 형광 R. buchneri 를 포함하는 진드기 세포 배양에 도전했습니다 . 무세포 리케치아/ 아나플라즈마 의 연속 희석액을 R. 부크네리 감염 IRE11 세포 가 주입된 24-웰 조직 배양 플레이트의 복제된 웰에 접종한 후 14일에 감염성을 측정했습니다. 세 가지 병원체 모두 R. buchneri 에 감염된 진드기 세포 배양에서 감염 및 복제 능력이 현저하게 감소한 것으로 나타났습니다 ( 그림 4), 심지어 낮은 수준의 Rb -GFPuv 감염으로 인해 병원체 감염 및 복제가 감소했습니다. 형광 현미경 검사는 R. monacensis 와 A. phagocytophilum이 R. buchneri 에 감염된 진드기 세포에서 복제되지 않는다는 것을 보여주었습니다 ( 보충 그림 S3 ). R. buchneri 에 감염된 진드기 세포 배양에서 R. monacensis, R. parkeri 또는 A. phagocytophilum 의 감염성은 R. buchneri가 없는 세포에 비해 3-5배 감소했습니다 ( 그림 4 ). R. buchneri 의다른 세포내 진드기 매개 박테리아의 성장을 억제했습니다. 또한, Rp- mKate 감염 동안 형광 현미경으로 감염된 세포의 백분율을 조사한 결과 R. buchneri가 없는 IRE11에서 세포가 14일 동안 모든 희석에서 완전히 감염되었음을 보여주었습니다( 그림 4D ). 대조적으로, Rp- mKate 감염은 45% 세포에서 내공생체를 포함하는 IRE11 배양에서만 낮은 수준(<10%)에 도달했으며 R. buchneri 를 포함하는 >95% 세포가 있는 배양에서는 거의 세포가 Rp-mKate 로 감염되지 않았습니다 .
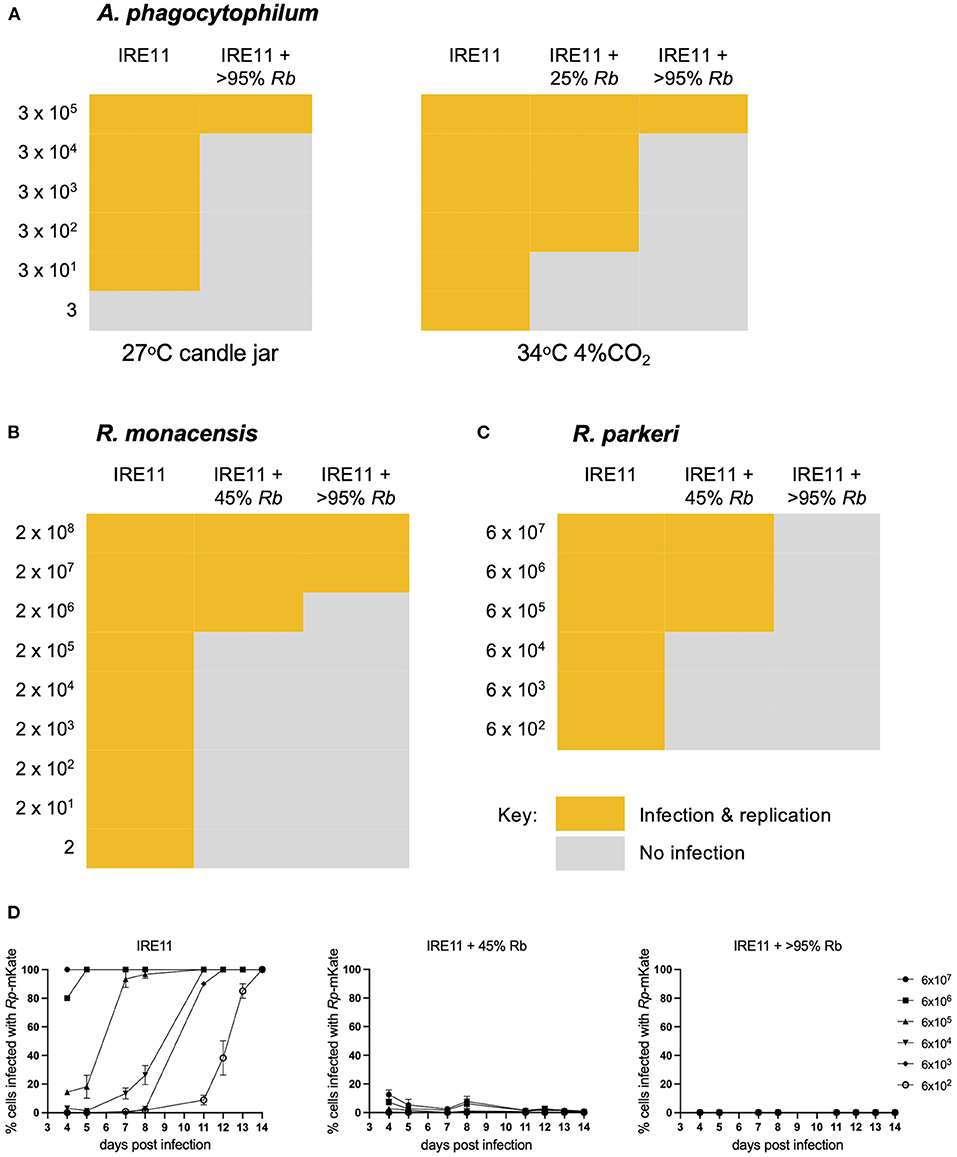
그림 4 . Rickettsia buchneri는 진드기 세포 배양에서 다른 진드기 매개 박테리아의 감염 및 복제를 억제합니다. 다양한 수준의 R. buchneri- GFPuv로 감염된 IRE11 세포를 적색 형광 A. phagocytophilum (A) , R. monacensis (B) 또는 R. parkeri (C) 의 연속 희석액으로 감염시키고 플레이트를 14일에 걸쳐 모니터링했습니다. 감염되지 않은 IRE11 세포와 비교하여 감염 및 복제. (D) R. parkeri- mKate 로 감염된 IRE11 세포의 백분율을 형광 현미경으로 평가했습니다. 6일, 9일 및 10일에 측정하지 않았습니다.
동시 감염 동안의 성장 역학을 추가로 조사하기 위해 형광 플레이트 판독기를 사용하여 감염되지 않은 IRE11과 비교하여 25, 50, 75 및 >95% 수준에서 Rb -GFPuv 로 감염된 IRE11 세포에서 Rp- mKate 의 복제를 측정했습니다. . GFPuv 측정은 Rb -GFPuv 로 감염의 다양한 수준을 명확하게 구별할 수 있었고 14일 실험에 걸쳐 내배엽의 꾸준한 복제를 나타냈습니다( 도 5A ). 감염되지 않은 IRE11에서는 GFPuv 형광의 증가가 관찰되지 않았습니다. 높은(1,000:1) 챌린지에서 Rp- mKate 성장의 형광은 Rp 의 빠른 감염 및 복제를 나타냅니다.- 감염되지 않은 IRE11의 mKate는 3일째부터 6일째부터 평준화되기 시작했습니다( 그림 5B ). 대조적으로, 4일 이후부터 모든 감염 수준에서 Rb- GFPuv 를 보유하는 IRE11에서 mKate 형광 증가율이 상당히 더 낮았고 ( p < 0.0001); 감염되지 않은 IRE11과 비교하여 14일에 Rb -GFPuv가 95% 이상인 IRE11에서 Rp -mKate 가 89% 감소했고 , Rb -GFPuv가 75%인 IRE11에서 88% 감소했으며 , Rb-GFPuv가 50%인 IRE11에서 84% 감소했습니다 . GFPuv, 및 25% Rb- GFPuv 로 IRE11에서 76% 감소 . 유사하게, 감염되지 않은 IRE11의 Rp- 100:1 챌린지mKate는 5일에서 6일까지 형광이 급격히 증가하여 12일에 최고점에 도달하여 세포에서 Rp- mKate의 복제 및 확산을 나타냅니다( 그림 5C ). 그러나 Rb- GFPuv가 포함된 IRE11에서는 mKate 형광의 유의한 차이가 6일째부터 관찰되었으며( p < 0.001), 14일째 감소는 50%, 75% 및 >95% 감염된 세포에서 99%, 95% IRE11에서 25% Rb -GFPuv. 낮은 챌린지(10:1)에서 mKate 형광은 감염되지 않은 IRE11에서 7일에서 8일까지 증가하고 13-14일에 최고에 도달한 반면, Rb -GFPuv에 감염된 IRE11 mKate 형광 은 50%, 75% 및 >95% 감염된 세포, 25% 감염된 세포에서 98%까지(도 5D ), Rb- GFPuv가 없는 IRE11과 비교하여 8일째( p < 0.0001)부터 현저한 차이가 나타납니다. Rp -mKate가 첨가되지 않은 대조군 웰에서는 mKate 형광의 변화가 관찰되지 않았습니다 (데이터는 표시되지 않음). 함께, 이러한 결과는 IRE11에서 R. buchneri 의 존재가 R. parkeri가 문화에서 성공적으로 감염 및 복제하는 능력에 상당한 억제 효과가 있음을 시사합니다.
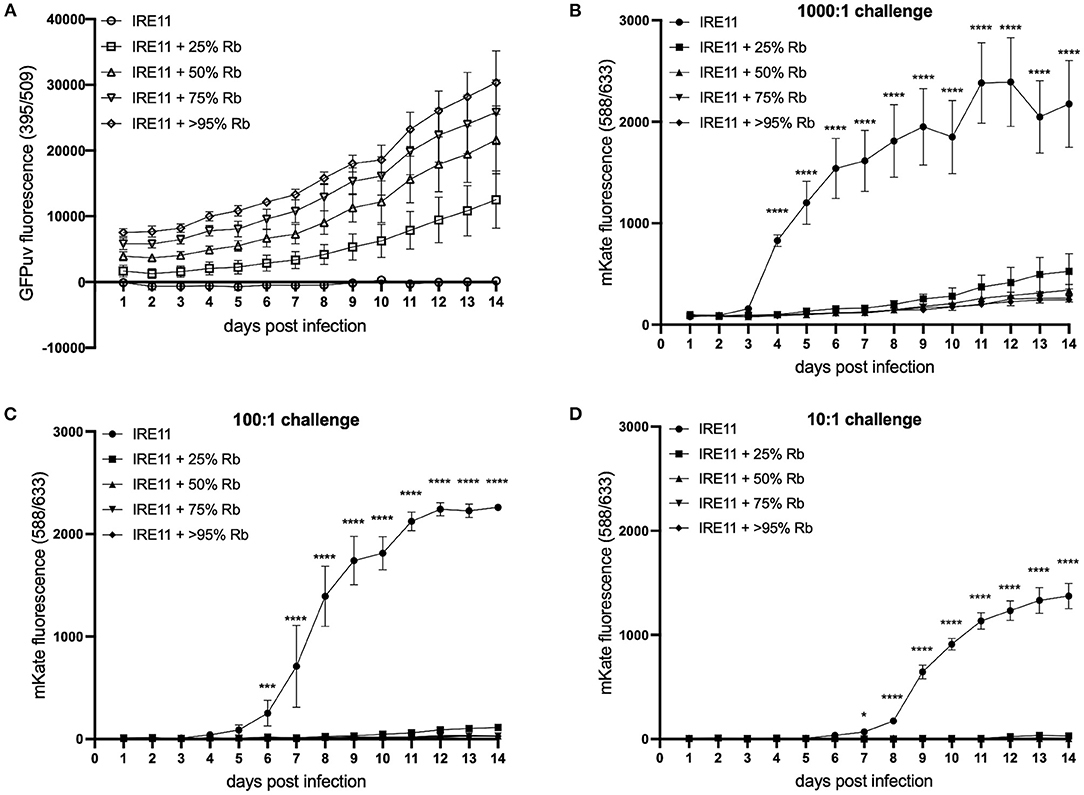
그림 5 . Rickettsia buchneri는 진드기 세포 배양에서 Rickettsia parkeri 의 감염 및 복제를 방지합니다 . 감염되지 않은 IRE11과 다른 수준의 R. buchneri- GFPuv로 감염된 IRE11은 다른 용량의 R. parkerimKate 로 감염되었습니다 . IRE11 세포의 Rickettsial 복제는 마이크로플레이트 판독기에서 GFPuv 및 mKate 형광을 측정하여 14일 동안 모니터링되었습니다. (A) R. buchneri -GFPuv 의 복제를 나타내는 GFPuv 형광 . (B–D) 1,000:1 (B) , 100:1 (C) 및 10:1 의 시험 투여량에서 R. parkeri- mKate 의 성장을 나타내는 mKate 형광(디) ; 선은 3개의 복제 웰의 평균 및 오차 막대 표준 편차를 보여줍니다. 평균은 Dunnett의 다중 비교 테스트와 함께 양방향 ANOVA를 사용하여 감염되지 않은 대조군 IRE11과 비교되었습니다. 통계적으로 유의미한 값은 별표 * p < 0.05, *** p < 0.001, **** p < 0.0001로 표시됩니다. 데이터는 독립적으로 수행된 두 실험을 대표합니다( 보충 그림 S4 참조 ).
관찰된 병원체 성장의 억제가 R. buchneri 에 의한 항생제 때문인지 아니면 이전에 관찰된 다양한 리케차 종 (항생제 합성 유전자 클러스터를 포함하지 않음) 사이에서( 70 – 73 ) 경쟁적 배제 때문인지 분리하기 위해 추가 상주 박테리아로서 R. buchneri 대신 다른 Rickettsia 종을 사용하여 플레이트 판독기 실험을 수행했습니다 . 첫째, 이것은 IRE11 세포에서 25 및 >95%의 감염 수준에서 저병원성 종 R. amblyommatis를 사용하여 평가되었으며 , 감염되지 않은 대조군 IRE11은 Rp-1,000:1(높음) 및 10:1(낮음)에서 mKate. Rb- GFPuv 로 얻은 결과와 대조적으로 , 진드기 세포에 R. amblyommatis가 존재하면 Rp- mKate 복제가 부분적으로만 억제됩니다. R. amblyommatis 에 감염된 IRE11에서 Rp- mKate 의 성장은 R. amblyommatis 감염 수준에 상대적인 방식으로 억제되었습니다 ( 도 6A,B ); 즉, 낮은 감염 수준(25%)에서 R. amblyommatis 가 없는 IRE11과 비교하여 Rp- mKate 의 억제가 더 낮았습니다 (10:1 챌린지에서 35% 억제, 1,000:1에서 37% 억제).14일째), 높은 수준의 감염(>95%)에서 Rp- mKate 의 억제가 더 높았습니다 (10:1 챌린지에서 54% 억제 및 1,000:1에서 56%).
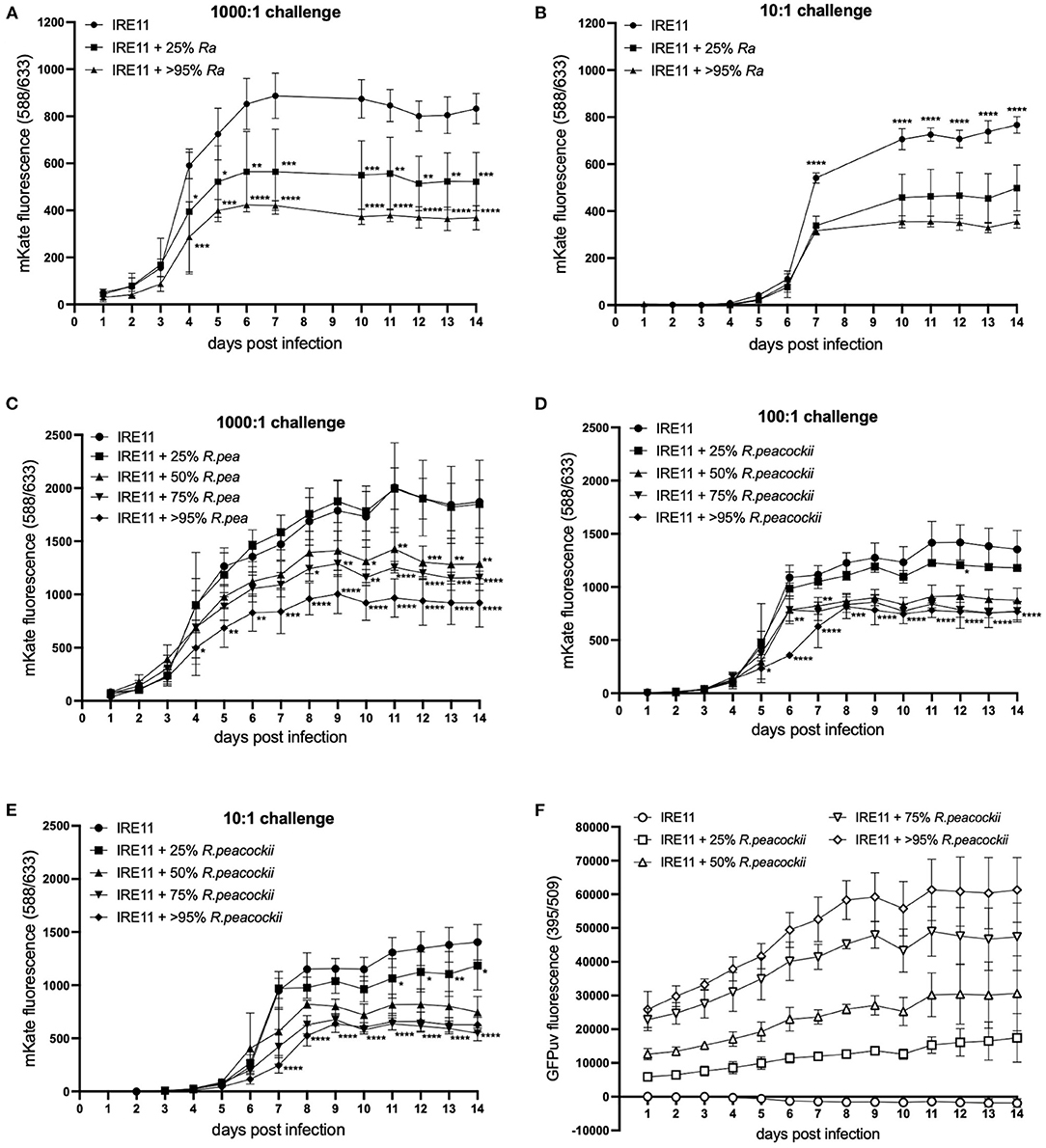
그림 6 . R. amblyommatis 또는 R. peacockii 존재 하에 Rickettsia parkeri 복제 . 마이크로플레이트 판독기에서 mKate 형광을 측정하여 진드기 세포에서 R. parkeri -mKate 의 복제를 14일 동안 모니터링했습니다. (A,B) 1,000:1 (A) 및 10:1 (B) 의 도전 투여량에서 양초 단지에서 28°C에서 R. amblyomatis가 있거나 없는 IRE11 세포에서 R. parkerimKate 복제 ; 8일 또는 9일에 읽지 않은 판독값. (C-E) R. peacockii- GFPuv 가 있거나 없는 IRE11 세포에서 R. parkerim-Kate 복제 , 28°C, 양초 단지에서 1,000:1의 시험 투여량으로 (C) , 100:1 (D) 및 10:1 (E). (F) R. peacockii- GFPuv 의 복제를 나타내는 GFPuv 형광 . 데이터는 3개의 복제 웰의 평균 및 오차 막대 표준 편차를 보여줍니다. 평균은 Dunnett의 다중 비교 테스트와 함께 양방향 ANOVA를 사용하여 감염되지 않은 대조군 IRE11과 비교되었습니다. 통계적으로 유의한 값은 별표 * p < 0.05, ** p < 0.01, *** p < 0.001, **** p < 0.0001로 표시됩니다. 데이터는 두 개의 독립적인 실험을 나타냅니다( 보충 그림 S4 참조 ).
내공생 리케차가 다른 병원성 리케차 종 보다 병원성 박테리아에 더 큰 배타적 영향을 미칠 수 있는지 여부를 조사하고 R. buchneri 에 의한 잠재적인 항생제 생산의 관여 기여도를 추가로 조사하기 위해 R. peacockii 를 사용하여 추가 플레이트 판독기 경쟁 분석을 수행했습니다. ( D. andersoni 의 내공생체 ) Rb- GFPuv 대신 . 웰은 감염되지 않은 IRE11 또는 R. peacockii- GFPuv로 감염된 IRE11을 25, 50, 75 및 >95% 수준으로 포함했습니다. 우물은 Rp-1,000:1, 100:1 및 10:1에서 mKate. 높은 챌린지(1,000:1) 웰에서, mKate 형광은 >95% R. peacockii -GFPuv로 감염된 세포에서 4일 이후에 R. peacockii -GFPuv가 없는 IRE11에서보다 현저히 낮았습니다( 도 6C ). 75% 또는 50% R. peacockii- GFPuv가 포함된 IRE11의 mKate 형광은 각각 8일 및 10일부터 상당히 낮았지만 25% R. peacockii- GFPuv가 포함된 IRE11에서 Rp- mKate의 성장은 IRE11과 크게 다르지 않았습니다. 내공생체 없이( 도 6C ). 14일째에 R. peacockii-가 없는 IRE11과 비교하여GFPuv, 50% R. peacockii -GFPuv를 포함하는 IRE11에서 mKate 형광의 31% 감소, 75% R. peacockii -GFPuv를 포함하는 IRE11에서 38% 감소 , >95% R을 포함하는 IRE11에서 51% 감소가 있었습니다. peacockii -GFPuv. 마찬가지로, 100:1 챌린지 웰에서 50, 75 및 >95% R. peacockii - GFPuv에 감염된 IRE11의 mKate 형광은 5일째(>95% ) 또는 6일(50 및 75%) 이후, 25% R. peacockii -GFPuv-감염 IRE11에서의 mKate 형광은 대조군과 유사하였다( 도 6D ). 14일째에 R. peacockii-가 없는 IRE11과 비교하여GFPuv는 각각 50, 75 및 >95% R. peacockii- GFPuv로 IRE11에서 측정된 mKate 형광에서 35%, 43% 및 43%의 감소가 있었습니다. 10:1 챌린지 실험에서, mKate 형광은 R. peacockii- GFPuv가 없는 IRE11에 비해 R. peacockii- GFPuv에 감염된 IRE11 50, 75 및 >95%에서 7일 이후부터 상당히 감소했습니다 ( 그림 6E ). R. peacockii- GFPuv 로 감염된 IRE11 25%에서 mKate 형광은 11일부터 14일까지 대조군보다 현저히 낮았습니다( 도 6E ). 14일째에 R. peacockii- GFPuv 가 없는 IRE11과 비교하여 mKate 형광은 IRE11에서 16, 47, 61 및 55% 감소했으며, 25, 50, 75 및 >95%로 감소했습니다.R. peacockii- GFPuv, 각각. GFPuv 형광의 측정은 25, 50, 75 및 >95% R. peacockii- GFPuv 로 감염된 IRE11의 다른 집단을 구별할 수 있었고 시간이 지남에 따라 R. peacockii- GFPuv 의 꾸준한 복제를 암시했습니다 ( 도 6F ). 감염되지 않은 IRE11에서는 GFPuv 형광의 증가가 관찰되지 않았습니다. 오히려, 감염된 세포에서 Rp- mKate 에 의한 IRE11의 용해로 인한 감소가 있었다 ( 도 6F ). 함께, 이러한 결과는 R. amblyommatis 도 R. peacockii도 R. buchneri 와 같은 정도로 경쟁하는 R. parkeri 의 성장을 억제하는 능력이 없음을 시사합니다 .
Rp -mKate 감염 에 대한 R. buchneri 의 억제 효과가 항생제 분비에 의한 것인지 여부를 확인하기 위해 추가 실험을 수행하였다. 감염되지 않은 IRE11을 96-웰 플레이트에 첨가한 다음 무세포 Rb - WT, 무세포 Rb- WT의 1:10 희석액, Rb- WT 로 심하게 감염된 IRE11의 용해물 또는 감염되지 않은 IRE11의 용해물로 처리했습니다. 2시간 후, 세포를 Rp- mKate 로 챌린지하였다 . Rp- 의 성장에 약간의 상당한 차이가 있었지만일부 처리 하에서 mKate는 세 가지 다른 시험 투여량에 걸쳐 일관성이 없었으며, 이는 예를 들어 시험 투여량 또는 세포 밀도와 같은 실험적 변동 때문임을 시사합니다( 도 7A-C ). 이러한 데이터를 종합하면 처리되지 않은 대조군 세포와 비교하여 R. parkeri 의 성장에 대한 처리의 명백한 효과가 없는 것으로 보입니다 . 또한, 이러한 결과는 R. buchneri가 R. parkeri 성장을 억제하기 위해 세포내일 필요가 있고 Rb- WT 용해물 의 세포외 첨가에 의한 항생제 효과도 없다는 것을 시사한다 .
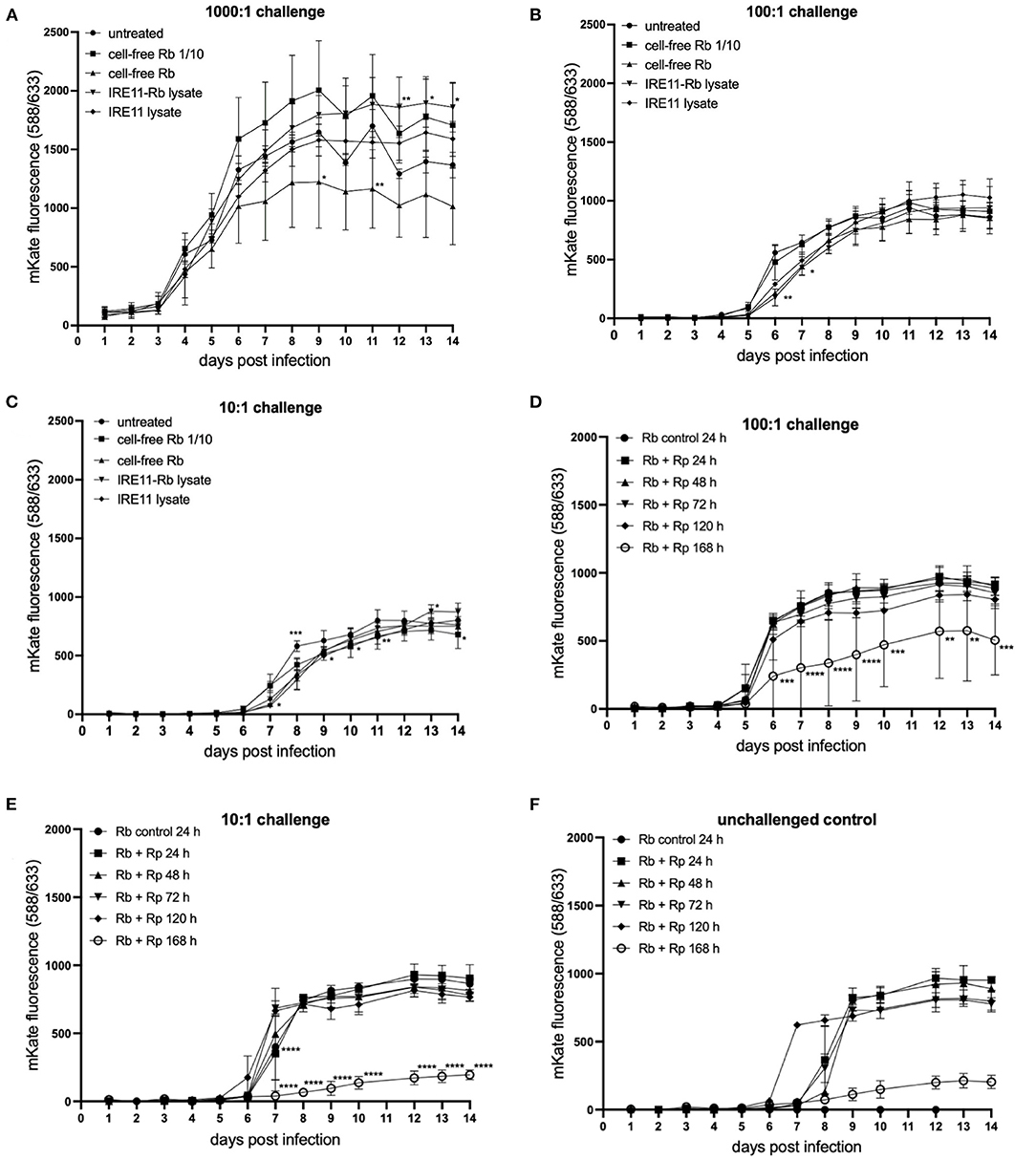
그림 7 . 무세포 R. buchneri 또는 R. buchneri 용해물로 처리된 IRE11에서 Rickettsia parkeri 복제 . 마이크로플레이트 판독기에서 mKate 형광을 측정하여 진드기 세포에서 R. parkeri -mKate 의 복제를 14일 동안 모니터링했습니다. (A–C) 무세포 R. buchneri , 용해물의 존재 하에 1,000:1 (A) , 100:1 (B) 및 10:1 (C) 의 도전 투여량에서 IRE11에서 R. parkeri -mKate 복제 R. buchneri 에 감염된 IRE11 또는 감염되지 않은 IRE11의 용해물. (D–F) 에서 용해물로 처리된 IRE11에서 R. parkerimKate 복제 R. buchneri는 24, 48, 72, 120 또는 168시간 동안 Rp- mKate 로 도전했습니다 . 처리된 세포는 100:1 (D) 또는 10:1 (E) Rp- mKate로 챌린지되었습니다. 확인되지 않은 제어는 실행 가능한 Rp- mKate가 세포 용해물 (F) 에 존재함을 나타냅니다 . 데이터는 3개의 복제 웰의 평균 및 오차 막대 표준 편차를 보여줍니다. 평균은 Dunnett의 다중 비교 테스트와 함께 양방향 ANOVA를 사용하여 감염되지 않은 대조군 IRE11과 비교되었습니다. 통계적으로 유의한 값은 별표 * p < 0.05, ** p < 0.01, *** p < 0.001, **** p < 0.0001로 표시됩니다.
Rp- mKate로 R. buchneri에 감염된 IRE11에 도전하면 Rp- mKate 에 대한 용해물의 억제 활성이 증가하는지 여부를 결정하기 위해 추가 실험을 수행했습니다 . 1-7일 동안 Rp -mKate로 챌린지된 IRE11로부터 분리된 무세포 Rb - WT 로부터 용해물을 제조 한 다음 96-웰 플레이트에서 IRE11 세포를 처리하는 데 사용했습니다. 그런 다음 웰을 이전과 같이 Rp- mKate로 1,000:1, 100:1 및 10:1의 도전 투여량으로 도전하고 mKate 형광을 14일 동안 측정하고 도전되지 않은 Rb-WT에 감염된 IRE11. 1,000:1 챌린지에서 대조군과 처리 사이에 mKate 형광에 차이가 없었으며( 보충 그림 S5 ), 다른 플레이트 판독기 실험과 유사한 성장 곡선을 보여줍니다. 그러나 100:1 및 10:1의 시험 투여량에서 Rp- mKate로 7일(168시간) 시험한 Rb -WT 의 용해물로 처리한 웰에서 대조군과 비교하여 mKate 형광에 상당한 차이가 있었습니다. 14일째에 각각 43% 및 77% 감소( 도 7D,E)). 다른 처리 그룹의 mKate 형광은 대조군 웰의 것과 유사했습니다. 실험에 도전하지 않은 대조군 웰을 실험에 통합하여 용해물에서 리케차의 생존 가능성을 확인했습니다. mKate 형광은 6-8일에 증가하는 것으로 관찰되었으며, 이는 생존 가능한 Rp- mKate가 용해물에 존재함을 시사합니다( 그림 7F ). 그러나 168-h-challenged lysate로 처리한 우물에서의 성장도 다른 처리 우물보다 훨씬 낮았습니다. 챌린지되지 않은 대조군 웰에서 mKate 형광이 챌린지된 웰에서보다 늦게 최고조에 달했다는 사실은 낮은 수준의 생존 가능한 Rp- mKate가 Rp-mKate에 도전한 우물. 전반적으로, 이러한 결과는 Rp- mKate 의 존재 하에서 7일 후에 Rb- WT의 용해물 이 더 낮은 용량(100:1 및 10:1)에서 IRE11 세포에서 Rp- mKate 의 복제를 억제할 수 있음을 나타냅니다. 이 시점에서 항생제 활동이 증가했기 때문입니다.
R. parkeri 감염 에 대한 항생제 유전자의 발현
R. buchneri 의 추정 항생제 클러스터의 유전자 발현이 잠재적으로 경쟁하는 박테리아의 존재에 대한 반응으로 상향 조절되는지 여부를 조사하기 위해 시간 경과 실험을 설정하고 qRT-PCR을 사용하여 선택된 유전자의 상대적 발현을 조사했습니다. 감염 동안 Rp- mKate 의 존재 및 부재에서 각 항생제 클러스터로부터 . 7일의 시간 경과에 걸쳐, 검사된 유전자 중 몇 개는 Rp- mKate로 여러 날의 도전에 대한 반응으로 상향 조절되는 것으로 나타났습니다( 그림 8 ). 그러나 반복 실험 간에는 큰 차이가 있었고 그 차이는 통계적으로 유의하지 않았습니다.
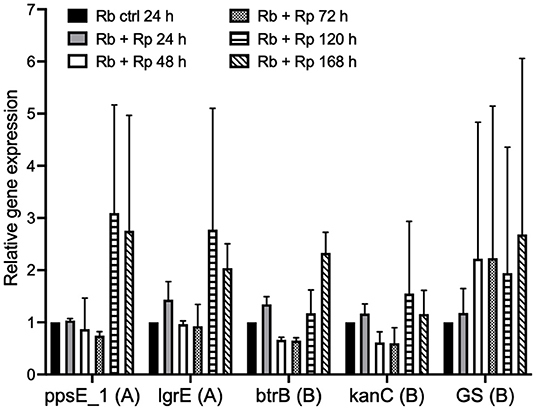
그림 8 . Rickettsia parkeri 도전 에 대한 R. buchneri 항생제 클러스터 유전자 의 발현 . 7일 동안 R. parkerimKate 챌린지 에 대한 R. buchneri 항생제 클러스터 유전자 의 상대적 발현 . 막대는 각 qRT-PCR 검정에 대한 2개의 독립적인 실험의 평균 및 표준 편차로서 대조군(공격받지 않은 R. buchneri )에 대한 각 유전자의 발현을 나타낸다. Ct 값은 감염된 IRE11 세포에서 GAPDH 발현 으로 정규화되었습니다 . polyketide 및 aminoglycoside 클러스터의 유전자는 각각 (A) 및 (B)로 표시됩니다. 평균은 Dunnett의 다중 비교 테스트와 함께 양방향 ANOVA를 사용하여 도전되지 않은 대조군과 비교되었습니다.
R. buchneri 항생제 활성 조사
세포외세균에 대한 R. buchneri 의 항생제 활성을 항생제 감수성 분석법을 사용하여 조사하였다. 여과지 디스크를 무세포 Rb- WT, Rb- WT-감염 IRE11, 및 다양한 수준의 Rb- WT(25%, 50% 및 >95%)로 감염된 IRE11 배양물로부터의 상청액으로 처리하였다. 스펙티노마이신(10 및 100μg) 처리 디스크를 양성 대조군으로 사용하고, 감염되지 않은 IRE11 세포 및 IRE11 배양 상청액을 음성 대조군으로 사용했습니다. 디스크를 E. coli 균주 D21 또는 S. aureus 균주 MN8 로 스트리킹한 Mueller-Hinton 한천 플레이트에 놓았다 . IRE11 또는 Rb- WT 유래 치료 중 어느 것도 다음을 억제하지 못했습니다.E. coli 또는 S. aureus 성장을 억제한 반면, 스펙티노마이신 처리된 디스크는 박테리아 성장을 방지했습니다( 표 4 ).
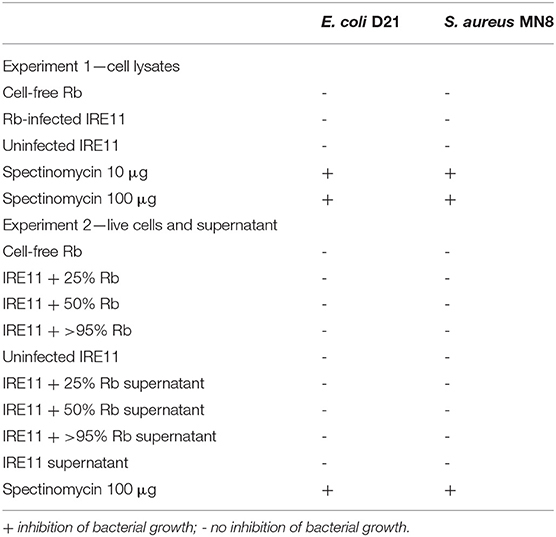
표 4 E. coli 및 S. aureus 에 대한 항생제 감수성 검사(디스크 확산 분석) 결과 .
Rb- WT 로 심하게 감염된 IRE11의 상청액은 또한 Vero 세포에서 성장하는 Rp- mKate 에 대한 활성에 대해 테스트되었습니다 . Rp- mKate 로 감염하기 전에 Vero 배양액에 상층액을 첨가해도 감염이 억제되지 않았습니다. 감염되지 않은 IRE11 배양액의 상청액을 사용한 중복 실험과 비교하여 플라크 형성의 진행 및 플라크 크기에서 관찰된 차이는 없었습니다( 보충 그림 S6 ).
논의
진드기 매개체에서 내공생 및 병원성 리케차 종 사이의 경쟁이 리케차 병원체의 지속성과 전파에 중요한 역할을 할 수 있다는 증거가 증가하고 있습니다 ( 70 – 73 ). 이 연구는 미네소타에서 분리된 I. scapularis endosymbiont R. buchneri 의 게놈에 두 개의 추정되는 항생제 합성 유전자 클러스터의 존재를 설명합니다 . 또한, 시험관 내 실험은 R. buchneri가 진드기 세포 배양에서 병원성 리케차의 성장에 억제 효과를 발휘한다는 것을 보여줍니다. R. buchneri 에 의한 R. parkeri 성장 억제이 연구에서 조사된 다른 리케차, 저병원성 R. amblyommatis 및 내공생 R. peacockii 에 의해 나타난 것보다 더 컸는데, 이는 이것이 R. buchneri 에 부족한 항생제 합성 유전자의 존재 때문임을 시사할 수 있습니다. 다른 리케차. 낮은 감염률에서도 R. buchneri 의 존재는 R. parkeri 성장 에 상당한 교란을 초래한 반면, R. amblyommatis 또는 R. peacockii 의 존재는 더 높은 감염률이 더 큰 감소로 이어지는 더 직접적인 경쟁을 보여주었습니다. R. parkeri 의 성장. 이러한 결과는 R. amblyommatis 또는 R. peacockii 를 동시에 감염시키는 경우 진드기에 의한 R. parkeri 또는 R. rickettsii 의 수평 및 수직 전파 감소를 시사하는 현재 현장 및 실험실 데이터에서 알려진 것과 관련이 있습니다 ( 70 , 72 , 73 ) R. buchneri 에 감염된 I. scapularis 에서 동시 감염 Rickettsia 종 의 거의 완전한 부재 . 이 억제와 항생제 합성 사이의 연관성은 아직 입증되지 않았지만, 이 작업은 R. buchneri 에 의한 항생제 생산 가능성을 높입니다.숙주 진드기에서 경쟁하는 세포내 박테리아를 배제하는 메커니즘일 수 있습니다.
클러스터의 유전자가 R. buchneri 에 의해 능동적으로 전사되지만, R. buchneri 에 감염된 배양액의 용해물 또는 상청액에서 R. parkeri 또는 세포외 박테리아 E. coli 및 S. aureus 에 대한 항생제 활성의 증거는 발견되지 않았습니다 . 그러나 R. parkeri 의 존재 하에서 7일 동안 성장시켰을 때, R. buchneri- 감염 세포 로부터의 용해물은 Rp- mKate의 더 낮은 시험 투여량(100:1 및 10:1)에 대해 약간의 억제 활성을 나타냈고, 이는 R. parkeri가 도전은 R. buchneri 의 항생제 활성을 유도할 수 있는 방아쇠가 될 수 있습니다.. 그러나 R. parkeri 가 있는 클러스터에서 특정 유전자의 발현을 검사하는 qRT-PCR의 결과는 매우 가변적이어서 결정적이지 않았습니다. 항생제 합성 클러스터의 규제에 대한 추가 정보를 얻기 위한 추가 분석은 그들이 R. parkeri 도전에 어떻게 반응하는지 이해하는 데 필요합니다. 예를 들어, 클러스터가 오페론으로 전사되는지 또는 항생제 생산을 위해 클러스터의 다른 구성 요소가 어떤 비율로 필요한지 알 수 없습니다. R. buchneri 에 의해 생성된 항생제 화합물자원을 놓고 경쟁할 수 있는 다른 박테리아에 의해 침입되는 내공생체가 거주하는 세포를 방지하기 위해 세포 내에서만 작용할 수 있습니다. 그러나 세포의 1/4만이 R. buchneri 에 의해 점유된 경우에도 R. parkeri 성장 이 억제된다는 사실은 R. parkeri 의 전달을 통해 잠재적으로 매개될 수 있는 이웃 세포에 대한 R. buchneri 의 일부 영향이 있어야 함을 시사합니다. 항균성이거나 세포가 감염에 저항하도록 만드는 인접 세포에 대한 화합물. 추정되는 화합물이 어떻게 수송될 수 있는지 뿐만 아니라 구루병 방지 활동의 메커니즘을 밝히기 위해서는 더 심층적인 연구가 필요합니다.
aminoglycoside 유전자 클러스터에 의해 암호화된 단백질은 Actinobacteria, 특히 Streptomyces spp. 및 Firmicutes( 54 ), polyketide 유전자 클러스터는 Gammaproteobacteria, 특히 Erwinia amylovora, Pantoea ananatis 및 Legionella spp .와 유사한 단백질을 암호화합니다 . 이것은 이러한 유전자 클러스터가 환경 박테리아에서 얻은 가능성이 있음을 시사합니다. 실제로, 이 문의 구성원은 I. scapularis microbiome 에서 확인되었습니다 ( 21 , 22 , 24 , 32 , 92 ). R. 부크네리게놈은 매우 유연한 것으로 알려져 있으며 여러 이동성 유전 요소와 다른 미생물의 유전 물질 섹션을 포함합니다( 54 ). 진드기는 토양, 잎사귀, 초목과 밀접한 관련이 있는 환경에서 삶의 많은 부분을 보내고 숙주를 찾고 먹이를 먹는 동안 동물의 피부와 혈액과 접촉하기 때문에 진드기와 마주칠 가능성이 높습니다. 이러한 유전자 클러스터가 옮겨질 수 있는 환경 박테리아. 가장 가능성이 높은 박테리아 분류군의 유전자 클러스터 및 유사한 경로에 대한 추가 조사를 통해 R. buchneri 에 의해 합성될 수 있는 항균 화합물에 대한 더 나은 이해를 얻을 수 있습니다., 그리고 이것은 이러한 제품의 향후 분리 및 특성화와 항균 활성 결정으로 이어질 수 있습니다. 예를 들어, Legionella spp. 벼 병원체 Xanthomonas oryzae에 대한 길항 활성(항생 작용에 기인)을 나타내는 Pantoea 및 Erwinia 종 에서 폴리케타이드 신타아제가 확인되었습니다 ( 94 ) . 유사하게, P. ananatis 와 P. agglomerans 의 균주는 E. amylovora 와 경쟁할 수 있도록 하는 항생제 생합성 클러스터를 포함합니다 ( 95, 96 ). 흥미롭게도 Rb ISO7 polyketide 클러스터에는 추정 유형 IV pilin이 포함됩니다. 이 단백질은 부착, 운동성, 생물막 형성, 숙주 세포 조작, DNA 전달 및 단백질 분비를 포함한 다양한 기능을 가지고 있습니다( 97 ). R. buchneri 에서 이 단백질의 역할을 추가로 조사하는 것은 흥미로울 것인데 , 이는 필린 클래스의 많은 기능이 클러스터의 항생 활성과 관련될 수 있기 때문입니다. 폴리케티드 클러스터의 대부분의 유전자는 REIS(Wikel) 게놈에 없으며, 이 영역의 일부 재조합이 있어 Rb 에서 발견되는 클러스터의 많은 부분이 절단되었을 수 있습니다.ISO7. 이것은 이 유전자 클러스터가 내공생체에 필수적이지 않으며 합성하는 항균 제품의 부족이 아미노글리코사이드 클러스터의 존재에 의해 보상된다는 것을 암시할 수 있습니다. REIS(Wikel) 게놈은 I. scapularis 의 실험실 콜로니에서 파생된 반면 Rb ISO7 게놈은 현장에서 수집된 진드기에서 유래되었으므로 REIS(Wikel)에서 이러한 유전자의 손실에 대한 대체 설명은 다음과 같습니다. 실험실에서의 생존에 필수적인 것은 아니지만 예를 들어 환경 미생물의 공격으로부터 보호하기 위해 자연 조건에서 필요할 수 있습니다. R. buchneri를 비교하기 위한 추가 실험REIS(Wikel)와 함께 폴리케티드 클러스터의 부재가 다른 박테리아와의 생존 또는 경쟁에 영향을 미치는지 여부를 결정할 수 있습니다.
시험관 내 감염 및 세포내 병원체 A. phagocytophilum, R. monacensis 및 R. parkeri 의 복제 에 대한 R. buchneri 의 억제 효과를 고려할 때 , 내공생체의 한 가지 역할은 진드기에서 병원체를 배제하는 것일 수 있습니다. R. buchneri는 주로 암컷 진드기의 난소로 제한되기 때문에 본질적으로 이 기관의 식민지화 및 후속하는 다른 Rickettsia 종과 같은 세포내 병원체의 경란성 전파를 방지하는 데 관여할 수 있습니다 . 진드기 세포 배양에서 A. phagocytophilum 의 억제가 관찰되었지만 R. buchneri 가A. 진드기 벡터 내의 식균 감염. Sakamotoet al . A. phagocytophilum 수준이 R. buchneri ( 19 ) 의 역가가 상당히 낮은 수컷 진드기에서 더 높다는 것을 발견한 반면 Steiner et al . R. buchneri 와 A. phagocytophilum 감염 유행 사이에 상관관계가 없음을 발견했지만 ( 48 ), 진드기 개체군에서 이 두 박테리아 사이의 상호작용을 조사한 다른 연구는 거의 없습니다. 유사하게, R. buchneri가 스피로헤타 B. burgdorferi 에 의한 I. scapularis 감염 에 어떤 영향을 미치는지 여부에 대한 데이터는 거의 없습니다.. Steiner와 동료들은 B. burgdorferi 감염률이 R. buchneri가 검출되지 않았을 때 유의하게 더 높았지만 수컷 I. scapularis 에서만 발견되었습니다 ( 48 ). 한 미생물 군집 연구에서는 Rickettsia 판독값이 B. burgdorferi 양성 진드기 에서 상당히 덜 풍부하다는 것을 발견한 반면( 98 ), 다른 연구 에서는 B. burgdorferi 양성 진드기와 음성 진드기 사이에 남성 또는 여성에 대한 박테리아 구성의 차이가 없음을 발견했습니다 ( 20 ). 이들 병원균 중 어느 것도 침샘 에 국한되는 A. phagocytophilum 과 함께 난소를 통해 전염되지 않습니다( 99 ).중장에 서식하는 B. burgdorferi ( 100 ). 두 병원체가 I. scapularis 개체군 에서 매우 널리 퍼져 있다는 사실은 R. buchneri가 가질 수 있는 항생제 활동이 난소에 제한될 가능성이 있다는 가설을 뒷받침합니다. 이 연구에서 진드기 매개 병원체의 R. buchneri 억제는 진드기 내부의 생명과 직접 비교할 수 없는 진드기 세포 배양 시스템에서 관찰되었습니다. 생체 외 난소( 101 ) 및/또는 살아있는 I. scapularis를 사용하여 이러한 병원체에 의한 감염에 대한 R. buchneri 의 영향을 조사하는 추가 연구이 경쟁의 역학에 대한 추가 통찰력을 제공해야 합니다. 시프로플록사신( 26 ) 을 사용하여 진드기에서 R. buchneri를 제거할 수 있는 기능을 통해 내배엽이 결여된 진드기에 대한 결과와 병원성 리케차에 감염되기 쉬운지 여부를 추가로 조사하기 위한 생체 내 연구를 향후 수행할 수 있습니다.
Ixodes pacificus , 미국 서부의 B. burgdorferi 및 A. phagocytophilum 의 주요 진드기 매개체는 또한 매우 널리 퍼진 리케차 내부 공생체인 " R. monacensis " 균주 Humboldt( 56 , 102 , 103 )를 보유하고 있으며 병원성을 매개하는 것으로 알려져 있지 않습니다. 리케차. 그러나 게놈 유사성 서열-역치 기준의 적용은 이 내공생체가 R. buchneri 및 R. monacensis 와 밀접하게 관련된 새로운 별개의 종이라는 것을 나타냅니다 ( 104 ). 또한, I. pacificus 는 종종 Rickettsia phylotype G022( 102, 103 ). 현재 계통형 G022에 대해 알려진 것은 거의 없지만 R. buchneri 및 Rickettsia 균주 Humboldt 보다 병원성 SFG rickettsiae와 더 밀접한 관련이 있습니다 ( 103 ). Cheng et al. 이전에 I. pacificus 에서 분리되었고 기니피그에서 약한 병원성을 나타내는 것으로 나타난 "Tillamook 물질"일 가능성이 있다고 제안했습니다 ( 105 , 106 ). 그러나 이 병원체는 최근 Rickettsia 의 과도기 그룹 ( 107 )과 관련된 별도의 종( R. tillamookensis sp. nov.) 으로 특성화되었으며 , 이는 I. pacificus를 의미합니다.그것의 endosymbiont 이외에 2개의 잠재적으로 병원성 rickettsiae와 연관됩니다. Rickettsia 균주 Humboldt 게놈(NZ_LAOP01000001.1)은 R. buchneri 에서 발견되는 것과 유사한 항생 유전자 클러스터를 포함하지 않는 것으로 보이며 , 이는 I. pacificus가 내공생 및 잠재적 병원성 종 모두에 동시 감염될 수 있는 한 가지 이유일 수 있습니다. 흥미롭게도, R. amblyomatis, R. montanensis 또는 R. parkeri를 포함하는 현장 수집 I. scapularis 가 때때로 발견되었습니다 ( 25 , 31 , 36 , 41 , 42 , 44 ,53 , 108 ), 이는 감염된 A. americanum 또는 D. variabilis 와 함께 숙주 먹이로부터의 "스필오버"를 통해 잠재적으로 발생할 수 있습니다 . 그러나 이러한 감염된 I. scapularis는 내공생체가 이 진드기에서 검출되지 않았기 때문에 R. buchneri가 부족한 개체인 것으로 보입니다 . I. scapularis 와 R. buchneri 및 R. parkeri 의 동시 감염 은 한 번만 보고되었으며( 44 ), 이는 R. parkeri- 감염된 A. maculatum, 감염된 혈액 식사에 병원체가 존재할 가능성이 있습니다.
리케차 사이의 간섭은 40년 전에 제안된 이후로 거의 연구되지 않았지만, 기존 연구에 따르면 첫 번째 리케차 종에 대한 감염은 두 번째 리케차 의 난소를 통한 전파를 감소시킬 수 있고 ( 70 , 71 , 73 ), 감염된 두 번째 리케차 의 획득을 줄일 수 있습니다. 숙주, 및/또는 진드기에서 복제를 감소시킵니다( 72 , 73 ). 이 모든 것은 잠재적으로 유행병 주기에서 병원성 리케차의 전파 감소로 이어질 수 있습니다. 이 연구에서 R. amblyommatis 또는 R. peacockii 의 존재는 다음의 능력을 감소시켰습니다.R. parkeri는 진드기 에 대한 생체 내 연구 에서 관찰된 것을 반영하여 진드기 세포에서 감염 및 복제합니다 ( 70 – 73 ). 그러나 이러한 간섭이 발생하는 메커니즘은 아직 밝혀지지 않았습니다. 제안된 한 가지 잠재적인 메커니즘은 세포외 리케차가 진드기 선천적 면역 반응을 자극하여 벡터가 두 번째 리케차 감염에 덜 취약하도록 만드는 면역 프라이밍입니다( 26 ) . 공생체는 다른 절지동물의 면역 발달과 병원체로부터의 보호에 중요한 것으로 나타났습니다( 109 – 111 ). 진드기 세포나 조직을 한 사람이 점유하는 것도 가능합니다.Rickettsia 종은 두 번째 Rickettsia 에 의해 감염되는 것을 물리적으로 방지하여 진드기에서 효과적으로 확산되고 복제되는 능력을 감소시킬 수 있습니다.
요약하면, 이 연구는 I. scapularis의 내공생체인 R. buchneri 가 세포 배양에서 병원성 진드기 매개 박테리아의 성장에 억제 효과를 발휘하고 추정되는 항생제 생합성 기계를 암호화하는 두 개의 유전자 클러스터를 보유하고 있다는 증거를 제공합니다. 이는 R. buchneri가 잠재적 인 영양 내배엽체일 뿐만 아니라 병원성 Rickettsia 종이 난소를 점유하는 것을 방지하는 서비스를 제공할 수 있음을 시사할 수 있습니다 . D. andersoni 및 D. variabilis ( 112 , 113). 이 연구에서 항생제 클러스터의 존재와 병원성 Rickettsiae의 성장을 억제하는 능력 사이의 상관관계가 발견되었지만 관찰된 억제가 R. buchneri 의 항생제 클러스터와 직접적으로 연결되어 있는지 확인하려면 추가 조사가 필요합니다. 생체 내 연구 의 지지 증거는 SFG 리케차에 대한 리케차 간섭 및 I. scapularis 의 벡터 능력에 대한 우리의 이해에 중요한 의미를 가질 수 있습니다 .
데이터 가용성 선언문
이 연구를 위해 생성된 데이터 세트는 미네소타 대학의 데이터 저장소( https://doi.org/10.13020/ZQXG-JF78 )에서 찾을 수 있습니다 .
저자 기여
BC, JO, TK 및 UM이 실험을 구상하고 설계했습니다. BC, NB, TK 및 X-RW가 실험을 수행했습니다. BC와 TK는 데이터를 분석했습니다. CT는 형광판 판독기 분석법을 개발했습니다. BC는 원고의 초안을 작성하고 수치를 준비했습니다. 모든 저자는 원고 수정에 기여했으며 제출된 버전을 승인했습니다.
펀딩
이 연구는 미국 국립보건원(National Institutes of Health) 보조금 R01 AI49424 및 R01 AI081690에서 UM( http://www.grants.nih.gov/grants/oer.htm )과 미네소타 대학 농업 실험 스테이션의 기금에서 관대한 자금 지원을 받았습니다. . 자금 제공자는 연구 설계, 데이터 수집 및 분석, 출판 결정 또는 원고 준비에 아무런 역할도 하지 않았습니다.
이해 상충
저자는 잠재적 이해 상충으로 해석될 수 있는 상업적 또는 재정적 관계가 없는 상태에서 연구가 수행되었음을 선언합니다.
게시자의 메모
이 기사에 표현된 모든 주장은 전적으로 저자의 주장이며 반드시 소속 기관이나 발행인, 편집자 및 검토자의 주장을 대변하지는 않습니다. 이 문서에서 평가할 수 있는 모든 제품 또는 해당 제조업체가 주장할 수 있는 주장은 게시자가 보증하거나 보증하지 않습니다.
감사의 말
Rickettsia buchneri ISO7 게놈 의 항생제 유전자 클러스터에 대한 예비 분석을 위해 Rod Felsheim(이전 미네소타 대학교 곤충학과)에게 감사드립니다 .
보충 자료
이 기사의 보충 자료는 온라인에서 찾을 수 있습니다 .
참조
1. Eisen RJ, Eisen L. 검은 다리 진드기, Ixodes scapularis: 증가하는 공중 보건 문제. 트렌드 기생충. (2018) 34:295–309. 도이: 10.1016/j.pt.2017.12.006
2. Oteo JA, Portillo A. 유럽의 진드기 매개 리케차증. 틱 틱 Borne Dis. (2012) 3:271–8. 도이: 10.1016/j.ttbdis.2012.10.035
3. Capligina V, Seleznova M, Akopjana S, Freimane L, Lazovska M, Krumins R 등. 2017-2019년 동안 라트비아에서 현장 수집된 진드기의 진드기 매개 병원체에 대한 대규모 전국 검사. 기생충 벡터. (2020) 13:351. 도이: 10.1186/s13071-020-04219-7
4. Sormunen JJ, Andersson T, Aspi J, Bäck J, Cederberg T, Haavisto N 등. 핀란드의 전국적인 연구소 네트워크를 통해 진드기 및 진드기 매개 병원체를 모니터링합니다. 틱 틱 Borne Dis. (2020) 11:101449. 도이: 10.1016/j.ttbdis.2020.101449
5. Klitgaard K, Kjær LJ, Isbrand A, Hansen MF, Bødker R. 덴마크의 레크리에이션 숲에서 수집된 님프 및 성인 여성 Ixodes ricinus 진드기를 탐색하는 다중 감염. 틱 틱 Borne Dis. (2019) 10:1060–5. 도이: 10.1016/j.ttbdis.2019.05.016
6. Knoll S, Springer A, Hauck D, Schunack B, Pachnicke S, Strube C. Anaplasma phagocytophilum 및 Rickettsia spp.의 지역, 계절, 격년 및 조경 관련 분포. 독일 북부의 Ixodes 진드기 감염 및 더 큰 공간 규모에서의 위험 평가에 대한 의미. 틱 틱 Borne Dis. (2021) 12:101657. 도이: 10.1016/j.ttbdis.2021.101657
7. Kjær LJ, Klitgaard K, Soleng A, Edgar KS, Lindstedt HEH, Paulsen KM 등 2016년 남부 스칸디나비아에서 Ixodes ricinus 님프를 조사할 때 병원체 유병률의 공간적 패턴. Sci Rep. (2020) 10:1–14. 도이: 10.1038/s41598-020-76334-5
8. Remesar S, Díaz P, Portillo A, Santibáñez S, Prieto A, Díaz-Cao JM 등. Rickettsia spp.의 유병률 및 분자 특성 스페인 북서부에서 진드기를 찾고 있습니다. 특급 Appl Acarol. (2019) 79:267–78. 도이: 10.1007/s10493-019-00426-9
9. Shao JW, Zhang XL, Li WJ, Huang HL, Yan J. 중국 북동부 하얼빈 지역 진드기의 리케차 분포 및 분자 특성. PLoS Negl Trop Dis. (2020) 14:e0008342. 도이: 10.1371/journal.pntd.0008342
10. Wang Q, Pan YS, Jiang BG, Ye RZ, Chang QC, Shao HZ 등 중국 북동부의 다양한 진드기 벡터에서 여러 진드기 매개 병원체의 유병률. 벡터 매개 Zoonotic Dis. (2021) 21:162–71. 도이: 10.1089/vbz.2020.2712
11. Liu H, Liang X, Wang H, Sun X, Bai X, Hu B 등. 중국 남서부 윈난성에서 온 진드기의 홍반열군 리케차에 대한 분자학적 증거. 특급 Appl Acarol. (2020) 80:339–48. 도이: 10.1007/s10493-020-00467-5
12. Rar V, Livanova N, Tkachev S, Kaverina G, Tikunov A, Sabitova Y 등. 러시아 서부 시베리아의 Ixodes pavlovskyi 진드기에서 광범위한 감염원의 검출 및 유전적 특성 규명. 기생충 벡터. (2017) 10:258. 도이: 10.1186/s13071-017-2186-5
13. Katargina O, Geller J, Ivanova A, Värv K, Tefanova V, Vene S, 외. 에스토니아 Ixodes 진드기 개체군에서 Rickettsia 종의 검출 및 식별. 틱 틱 Borne Dis. (2015) 6:689–94. 도이: 10.1016/j.ttbdis.2015.06.001
14. Igolkina Y, Bondarenko E, Rar V, Epikhina T, Vysochina N, Pukhovskaya N 등. Rickettsia spp.의 유전적 다양성 Ixodes persulcatus에서 진드기는 러시아 극동의 대륙 및 섬 지역에서 발생합니다. 틱 틱 Borne Dis. (2016) 7:1284–9. 도이: 10.1016/j.ttbdis.2016.06.005
15. Cheng C, Fu W, Ju W, Yang L, Xu N, Wang Y 등. 중국-러시아 국경의 쑤이펀허에서 발생하는 딱딱한 진드기에서 발견되는 홍반열 그룹 리케차 감염의 다양성. 틱 틱 Borne Dis. (2016) 7:715–9. 도이: 10.1016/j.ttbdis.2016.02.023
16. Graves SR, Stenos J. 호주의 진드기 매개 전염병. Med J Aust. (2017) 206:320–4. 도이: 10.5694/mja17.00090
17. Graves SR, Jackson C, Hussain-Yusuf H, Vincent G, Nguyen C, Stenos J 등. Ixodes holocyclus 진드기가 호주 뉴사우스웨일스 북동부에서 인간 병원체를 전염시켰습니다. Trop Med Infect Dis. (2016) 1:4. 도이: 10.3390/tropicalmed1010004
18. Kurtti TJ, Felsheim RF, Burkhardt NY, Oliver JD, Heu CC, Munderloh UG. Rickettsia buchneri sp. nov, 검은 다리 진드기 Ixodes scapularis의 리케차 내부 공생체. Int J Syst Evol Microbiol. (2015) 65:965–70. 도이: 10.1099/ijs.0.000047
19. 사카모토 J, 디아즈 GES, 바그너 EA. 미국 펜실베니아 중부에서 Ixodes scapularis의 박테리아 군집. 곤충. (2020) 11:718. 도이: 10.3390/insects11100718
20. 타파 S, 장 Y, 알렌 MS. 미국 매사추세츠와 텍사스에서 수집한 Ixodes scapularis 진드기의 박테리아 미생물. BMC 마이크로비올. (2019) 19:138. 도이: 10.1186/s12866-019-1514-7
21. Van Treuren W, Ponnusamy L, Brinkerhoff RJ, Gonzalez A, Parobek CM, Juliano JJ 등. Ixodes 진드기의 미생물군은 지리, 종 및 성별에 따라 다양합니다. Appl Environ Microbiol. (2015) 81:6200–9. 도이: 10.1128/AEM.01562-15
22. Zolnik CP, Prill RJ, Falco RC, Daniels TJ, Kolokotronis SO. 진드기 병원균 매개체의 개체 발생을 통해 마이크로바이옴이 변화합니다. 몰 에콜. (2016) 25:4963–77. 도이: 10.1111/mec.13832
23. Rynkiewicz EC, Hemmerich C, Rusch DB, Fuqua C, Clay K. 두 진드기 종의 박테리아 군집과 공유 설치류 숙주의 혈액 일치. 몰 에콜. (2015) 24:2566–79. 도이: 10.1111/mec.13187
24. 타파 S, 장 Y, 알렌 MS. Ixodes scapularis 진드기의 박테리아 미생물 군집 구성에 대한 온도의 영향. 미생물학open. (2019) 8:e00719. 도이: 10.1002/mbo3.719
25. Brinkerhoff RJ, Clark C, Ocasio K, Gauthier DT, Hynes WL. Ixodes scapularis 및 Amblyomma americanum의 미생물 군집에 영향을 미치는 요인. 플로스 원. (2020) 15:e0232398. 도이: 10.1371/journal.pone.0232398
26. Olafson PU, Buckmeier BG, May MA, Thomas DB. 남부 텍사스의 흰꼬리 사슴(Odocoileus virginianus)과 닐가이 영양(Boselaphus tragocamelus)에서 조사한 ixodid 진드기의 리케차 박테리아 및 피로플라즘에 대한 분자 스크리닝. Int J Parasitol Parasites Wildl. (2020) 13:252–60. 도이: 10.1016/j.ijppaw.2020.11.002
27. Al-Khafaji AM, Armstrong SD, Varotto Boccazzi I, Gaiarsa S, Sinha A, Li Z 등. 사슴진드기 Ixodes scapularis의 공생체인 Rickettsia buchneri는 숙주의 타액선에 서식할 수 있습니다. 틱 틱 Borne Dis. (2020) 11:101299. 도이: 10.1016/j.ttbdis.2019.101299
28. Livengood J, Hutchinson ML, Thirumalapura N, Tewari D. Babesia, Borrelia, Anaplasma, Rickettsia spp의 검출. Luminex multiplex bead assay로 미국 펜실베니아의 성체 검은다리 진드기(Ixodes scapularis)에서. 벡터 매개 Zoonotic Dis. (2020) 20:406–11. 도이: 10.1089/vbz.2019.2551
29. Hodo CL, Forgacs D, 오클랜드 LD, Bass K, Lindsay C, Bingaman M, 외. 다양한 Rickettsia spp.의 존재 통제된 화상과 관련된 감소된 진드기 밀도를 갖는 동부 텍사스 숲의 진드기에서 Borrelia burgdorferi sensu lato의 부재. 틱 틱 Borne Dis. (2020) 11:101310. 도이: 10.1016/j.ttbdis.2019.101310
30. Oliver JD, Price LD, Burkhardt NY, Heu CC, Khoo BS, Thorpe CJ 등. 진드기 Ixodes scapularis (Acari: Ixodidae)에서 공생 Rickettsia buchneri 의 성장 역학 및 항생제 제거 . Appl Environ Microbiol. (2020) 87:e01672–20. 도이: 10.1128/AEM.01672-20
31. Pokutnaya D, Molaei G, Weinberger DM, Vossbrinck CR, Diaz AJ. 미국 코네티컷의 Ixodes scapularis (Acari: Ixodidae)에서 감염 및 공동 감염의 유병률과 Rickettsial 내공생체의 존재. 제이 기생충. (2020) 106:30–7. 도이: 10.1645/19-116
32. Molaei G, Little EAH, Stafford KC, Gaff H A. 7족진드기: Ixodes scapularis(Acari: Ixodidae)가 미국 북동부에서 인간 숙주를 무는 형태학적 이상에 대한 보고. 틱 틱 Borne Dis. (2020) 11:101304. 도이: 10.1016/j.ttbdis.2019.101304
33. Gleim ER, Conner LM, Zemtsova GE, Levin ML, Wong P, Pfaff MA 등. 미국 조지아주 남서부와 플로리다주 북서부에서 실외 작업자에게서 제거된 진드기의 리케차알레스. 비상 감염 Dis. (2019) 25:1019–21. 도이: 10.3201/eid2505.180438
34. Tokarz R, Tagliafierro T, Sameroff S, Cucura DM, Oleynik A, Che X 등. 뉴욕과 코네티컷의 Ixodes scapularis 진드기에 대한 미생물 분석. 틱 틱 Borne Dis. (2019) 10:894–900. 도이: 10.1016/j.ttbdis.2019.04.011
35. Gleim ER, Zemtsova GE, Berghaus RD, Levin ML, Conner M, Yabsley MJ. 자주 처방된 화재는 진드기 매개 질병의 위험을 줄일 수 있습니다. Sci Rep. (2019) 9:9974. 도이: 10.1038/s41598-019-46377-4
36. Landesman WJ, Mulder K, Fredericks LP, Allan BF. Borrelia burgdorferi 감염 및 부하와 관련하여 님프 단계 Ixodes scapularis 미생물 군집의 왕국 간 분석. FEMS Microbiol Ecol . (2019) 95: fiz167. 도이: 10.1093/femsec/fiz167
37. Sanchez-Vicente S, Tagliafierro T, Coleman JL, Benach JL, Tokarz R. 진드기 매개 질병의 다균성. MBio. (2019) 10:e02055–19. 도이: 10.1128/mBio.02055-19
38. Mendell NL, Reynolds ES, Blanton LS, Hermance ME, Londoño AF, Hart CE 등 2017-2018년 텍사스 워커 카운티에서 수집한 진드기에서 Rickettsiae, Borreliae 및 Ehrlichiae 검출. 곤충. (2019) 10:315. 도이: 10.3390/insects10100315
39. Hagen R, Verhoeve VI, Gillespie JJ, Driscoll TP. Conjugative transposons 및 그들의 화물 유전자는 진드기 Ixodes scapularis를 감염시키는 Rickettsia buchneri의 자연 개체군에 따라 다릅니다. 게놈 바이올 에볼루션. (2018) 10:3218–29. 도이: 10.1093/gbe/evy247
40. 듀비 TR, 터너 J, 노덴 BH. 오클라호마의 Ixodes scapularis(Acari: Ixodidae)에서 진드기 매개 박테리아의 탐구 행동 및 분석. J Med Entomol. (2018) 55:1569–74. 도이: 10.1093/jme/tjy133
41. Castellanos AA, Medeiros MCI, Hamer GL, Morrow ME, Eubanks MD, Teel PD 등. 침습성 붉은 수입 불개미(Solenopsis invicta)와 관련하여 작은 포유동물과 숙주 진드기의 수가 감소했습니다. 비올 레트. (2016) 12:20160463. 도이: 10.1098/rsbl.2016.0463
42. Sayler K, Rowland J, Boyce C, Weeks E. Borrelia burgdorferi DNA 부재, 다수의 Rickettsia spp. 플로리다 중북부의 교육 숲에서 채취한 진드기에 존재하는 DNA. 틱 틱 Borne Dis. (2017) 8:53–9. 도이: 10.1016/j.ttbdis.2016.09.016
43. Gleim ER, Garrison LE, Vello MS, Savage MY, Lopez G, Berghaus RD 등. 미국 조지아에서 사람을 기생시키는 진드기의 진드기 물림 및 병원체 유병률과 관련된 요인. 기생충 벡터. (2016) 9:125. 도이: 10.1186/s13071-016-1408-6
44. Mitchell EA, Williamson PC, Billingsley PM, Seals JP, Ferguson EE, Allen MS. 미국 텍사스의 인간 기생 진드기에서 검출된 Rickettsiae, Borreliae 및 Ehrlichiae의 빈도 및 분포. 비상 감염 Dis. (2016) 22:312–5. 도이: 10.3201/eid2202.150469
45. 송어 Fryxell RT, Steelman CD, Szalanski AL, Billingsley PM, Williamson PC. 미국 아칸소에서 수집한 진드기(Acari: Ixodidae) 내 Rickettsia 종의 분자 검출. J Med Entomol. (2015) 52:500–8. 도이: 10.1093/jme/tjv027
46. Lee S, Kakumanu ML, Ponnusamy L, Vaughn M, Funkhouser S, Thornton H 등. 노스캐롤라이나에서 야외 근로자의 피부에서 제거한 진드기에서 리케치알레스의 유병률. 기생충 벡터. (2014) 7:607. 도이: 10.1186/s13071-014-0607-2
47. Mays SE, Hendricks BM, Paulsen DJ, Houston AE, Trout Fryxell RT. 테네시주 서부의 흰꼬리사슴에서 제거된 성인 Ixodes scapularis에서 5개의 진드기 매개 박테리아 속 유병률. 기생충 벡터. (2014) 7:473. 도이: 10.1186/s13071-014-0473-y
48. 레이데 BF, 리앙 FT. 루이지애나 흑곰(Ursus americanus luteolus)에서 채집한 진드기에서 인간 세균성 병원균 검출. 틱 틱 Borne Dis. (2013) 4:191–6. 도이: 10.1016/j.ttbdis.2012.12.002
49. Williamson PC, Billingsley PM, Teltow GJ, Seals JP, Turnbough MA, Atkinson SF. 보렐리아, 에를리치아, 리케차 종. 사람에게서 제거된 진드기, 미국 텍사스. 비상 감염 Dis. (2010) 16:441–6. 도이: 10.3201/eid1603.091333
50. Mead DG, Huang J, Fritzen CM, Dunn JR, Cohen SB, Dunlap BG 등. Rickettsia rickettsii의 부재 및 Tennessee의 진드기에서 다른 홍반열 그룹 Rickettsiae의 발생. J Trop Med Hyg입니다. (2010) 83:653–7. 도이: 10.4269/ajtmh.2010.09-0197
51. Yabsley MJ, Nims TN, Savage MY, Durden LA. 조지아 및 플로리다에서 온 흑곰(Ursus americanus floridanus)의 진드기 및 진드기 매개 병원체 및 추정 공생체. 제이 기생충. (2009) 95:1125–8. 도이: 10.1645/GE-2111.1
52. Steiner FE, Pinger RR, Vann CN, Grindle N, Civitello D, Clay K., 외. 인디애나, 메인, 펜실베이니아 및 위스콘신 지역의 Anaplasma phagocytophilum 변이체, Babesia spp, Borrelia burgdorferi 및 Ixodes scapularis(Acari: Ixodidae)의 리케차 내공생체의 감염 및 공동 감염률. 제이메드 엔토몰 . (2009) 45:289–97. 도이: 10.1093/jmedent/45.2.289
53. Swanson KI, Norris DE. 메릴랜드에서 Ixodes scapularis nymphs를 탐구하는 공동 순환 미생물. J 벡터 에코. (2007) 32:243. 도이: 10.3376/1081-1710(2007)32[243:CMIQIS]2.0.CO;2
54. Gillespie JJ, Joardar V, Williams KP, Driscoll T, Hostetler JB, Nordberg E 등. 모바일 유전 요소에 의해 오버런된 리케차 게놈은 필수 세포 내 생활 방식의 특징인 유전자 획득에 대한 통찰력을 제공합니다. J 박테리올. (2012) 194:376–94. 도이: 10.1128/JB.06244-11
55. Hunter DJ, Torkelson JL, Bodnar J, Mortazavi B, Laurent T, Deason J 등 Ixodes pacificus의 Rickettsia 내공생체는 새로운 엽산 생합성의 모든 유전자를 포함합니다. 플로스 원. (2015) 10:e0144552. 도이: 10.1371/journal.pone.0144552
56. Alowaysi M, Chen J, Stark S, Teague K, LaCourse M, Proctor J 등. 서부검은다리진드기 Ixodes pacificus의 난소에서 리케차의 분리 및 특성화. 틱 틱 Borne Dis. (2019) 10:918–23. 도이: 10.1016/j.ttbdis.2019.04.017
57. Salje J. 세포 내 세포: Rickettsiales 및 의무적 세포내 박테리아 라이프스타일. Nat Rev Microbiol. (2021) 19:375–90. 도이: 10.1038/s41579-020-00507-2
58. 질병통제예방센터. 역학 및 통계 - 로키산 홍반열. (2018). 온라인 이용 가능: https://www.cdc.gov/rmsf/stats/index.html(2021 년 7월 13일 액세스).
59. Dahlgren SF, Paddock CD, Springer YP, Eisen RJ, Behravesh CB. 미국에서 Amblyomma americanum의 범위 확대와 홍반열군 리케차병의 역학 변화 동시. J Trop Med Hyg입니다. (2016) 94:35–42. 도이: 10.4269/ajtmh.15-0580
60. 레빈 ML, 젬초바 GE, 킬마스터 LF, 스넬그로브 A, 슈마허 LBM. Rickettsia rickettsii에 대한 Amblyomma americanum(Acari: Ixodidae)의 벡터 능력. 틱 틱 Borne Dis. (2017) 8:615–22. 도이: 10.1016/j.ttbdis.2017.04.006
61. Breitschwerdt EB, Hegarty BC, Maggi RG, Lantos PM, Aslett DM, Bradley JM. Rickettsia rickettsii는 노스캐롤라이나주 론스타틱에 의해 전염됩니다. 비상 감염 Dis. (2011) 17:873–5. 도이: 10.3201/eid1705.101530
62. Goddard J. Lone star 진드기의 실험적 감염. Amblyomma americanum(L), Rickettsia parkeri 및 작용제에 대한 기니피그 노출. J Med Entomol. (2003) 40:686–9. 도이: 10.1603/0022-2585-40.5.686
63. Paddock CD, Sumner JW, Comer JA, Zaki SR, Goldsmith CS, Goddard J 등. Rickettsia parkeri: 미국에서 새롭게 알려진 홍반열 리케차증의 원인입니다. Clin Infect Dis. (2004) 38:805–11. 도이: 10.1086/381894
64. Yen WY, Stern K, Mishra S, Helminiak L, Sanchez-Vicente S, Kim HK. 생쥐의 홍반열 병인에 대한 Rickettsia amblyommatis의 병독성 가능성. 파토그 디스 . (2021) 79:ftab024. 도이: 10.1093/femspd/ftab024
65. Snellgrove AN, Krapiunaya I, Scott P, Levin ML. 기니피그 모델에서 Rickettsia amblyomatis, Rickettsia bellii 및 Rickettsia montanensis의 병원성 평가. 벡터 매개 Zoonotic Dis. (2021) 21:232–41. 도이: 10.1089/vbz.2020.2695
66. Billeter SA, Blanton HL, Little SE, Levy MG, Breitschwerdt EB. 진드기에 물린 발진과 관련된 "Rickettsia amblyommii"의 검출. 벡터 매개 Zoonotic Dis. (2007) 7:607–10. 도이: 10.1089/vbz.2007.0121
67. Paddock CD, Goddard J. 걸프 해안 진드기(Acari: Ixodidae)의 진화하는 의학적 및 수의학적 중요성. J Med Entomol. (2015) 52:230–52. 도이: 10.1093/jme/tju022
68. Molaei G, Little EAH, Khalil N, Ayres BN, Nicholson WL, Paddock CD. 코네티컷에서 Rickettsia parkeri(Rickettsiales: Rickettsiaceae)에 감염된 걸프 해안 진드기, Amblyomma maculatum(Acari: Ixodidae)의 확립된 개체군. J Med Entomol. (2021) 58:1459–62. 도이: 10.1093/jme/tjaa299
69. Phillips VC, Zieman EA, Kim CH, Stone CM, Tuten HC, Jiménez FA. 걸프 해안 진드기( Amblyomma maculatum ) 및 Rickettsia parkeri 의 확장에 대한 문서화 : 일리노이주에서 첫 번째 보고. 제이 기생충. (2020) 106:9–13. 도이: 10.1645/19-118
70. Burgdorfer W, Hayes S, Mavros A. Dermacentor andersoni 의 비병원성 리케차 : 리케차 리케차 의 분포에 대한 제한 요인 . 에서: Burgdorfer W, Anacker R, 편집자. 리케차 및 리케차 질병. 뉴욕: 아카데믹 프레스. (1981) p. 585–594.
71. Macaluso KR, Sonenshine DE, Ceraul SM, Azad AF. Dermacentor variabilis(Acari: Ixodidae)의 Rickettsial 감염은 두 번째 Rickettsia의 난소를 통한 전파를 억제합니다. J Med Entomol. (2002) 39:809–13. 도이: 10.1603/0022-2585-39.6.809
72. Wright CL, Sonenshine DE, Gaff HD, Hynes WL. Amblyomma maculatum(Acari: Ixodidae)과 함께 먹이를 먹임으로써 Amblyomma americanum으로 Rickettsia parkeri 전파 및 유출 가능성. J Med Entomol. (2015) 52:1090–5. 도이: 10.1093/jme/tjv086
73. Levin ML, Schumacher LBM, Snellgrove A. Rickettsia rickettsii에 대한 Amblyomma americanum 진드기의 벡터 능력에 대한 Rickettsia amblyomatis 감염의 효과. 벡터 매개 Zoonotic Dis. (2018) 18:579–87. 도이: 10.1089/vbz.2018.2284
74. Paddock CD, Denison AM, Dryden MW, Noden BH, Lash RR, Abdelghani SS 등. 캔자스와 오클라호마의 성인 Amblyomma maculatum(Acari: Ixodidae)에서 "Candidatus Rickettsia andeanae"의 높은 유병률과 Rickettsia parkeri의 명백한 배제. 틱 틱 Borne Dis. (2015) 6:297–302. 도이: 10.1016/j.ttbdis.2015.02.001
75. Larkin MA, Blackshields G, Brown NP, Chenna R, McGettigan PA, McWilliam H. 등. Clustal W 및 Clustal X 버전 20. 생물 정보학. (2007) 23:2947–8. doi: 10.1093/bioinformatics/btm404
76. 에드가 RC. MUSCLE, 고정확도 및 처리량이 높은 다중 서열 정렬. 핵산 Res. (2004) 32:1792–7. 도이: 10.1093/nar/gkh340
77. Munderloh UG, Jauron SD, Fingerle V, Leitritz L, Hayes SF, Hautman JM 등 진드기 세포 배양에서 Human Granulocytic Ehrlichiosis 에이전트의 침입 및 세포 내 개발. J Clin Microbiol. (1999) 37:2518–24. 도이: 10.1128/JCM.37.8.2518-2524.1999
78. Simser JA, Palmer AT, Fingerle V, Wilske B, Kurtti TJ, Munderloh UG. Rickettsia monacensis sp. nov, 유럽의 도시 공원에서 수집된 진드기(Ixodes ricinus)에서 유래한 반점열병군 리케차. Appl Environ Microbiol. (2002) 68:4559–66. 도이: 10.1128/AEM.68.9.4559-4566.2002
79. Kurtti TJ, Simser JA, Baldridge GD, Palmer AT, Munderloh UG. Rocky Mountain wood tick, Dermacentor andersoni(Acari, Ixodidae)의 내공생체인 Rickettsia peacockii(Rickettsiales: Rickettsiaceae)의 체외 감염 및 성장에 영향을 미치는 요인. J Invertebr Pathol. (2005) 90:177–86. 도이: 10.1016/j.jip.2005.09.001
80. Kurtti TJ, Burkhardt NY, Heu CC, Munderloh UG. 공생체-진드기 세포 상호작용을 추적하기 위한 Rickettsia buchneri 및 Rickettsia peacockii를 발현하는 형광 단백질. 수의사 과학. (2016) 3:34. 도이: 10.3390/vetsci3040034
81. Wang XR, Burkhardt NY, Kurtti TJ, Oliver JD, Price LD, Cull B 등. 미토콘드리아 의존성 세포사멸은 Rickettsia parkeri 감염 및 벡터 세포에서의 복제에 필수적입니다. m시스템 . (2021) 6. doi: 10.1128/mSystems.01209-20
82. Felsheim RF, Herron MJ, Nelson CM, Burkhardt NY, Barbet AF, Kurtti TJ 등. Anaplasma phagocytophilum의 형질전환. 비엠씨바이오텍. (2006) 6:42. 도이: 10.1186/1472-6750-6-42
83. Oliver JD, Burkhardt NY, Felsheim RF, Kurtti TJ, Munderloh UG. 이종 rickA 유전자를 과발현하도록 형질전환된 Rickettsia bellii에 대해 운동성 특성이 변경됩니다. Appl Environ Microbiol. (2014) 80:1170–6. 도이: 10.1128/AEM.03352-13
84. Ammerman NC, Beier-Sexton M, Azad AF. Vero 세포주의 성장 및 유지. Curr Protoc Microbiol . (2008) 11: 부록 4E. 도이: 10.1002/9780471729259.mca04es11
85. 파플 MW. 실시간 PCR의 정량화 전략. Bustin S에서 편집자. 정량적 PCR의 AZ . La Jolla, CA: International University Line. (2004) 페이지. 87–112.
86. Staunton J, Weissman KJ. Polyketide 생합성: 밀레니엄 리뷰. Nat Prod Rep. (2001) 18:380–416. 도이: 10.1039/a909079g
87. 월시 CT. Polyketide 및 nonribosomal 펩타이드 항생제: 모듈성 및 다양성. 과학. (2004) 303:1805–10. 도이: 10.1126/science.1094318
88. Keating TA, Ehmann DE, Kohli RM, Marshall CG, Trauger JW, Walsh CT. 비리보솜 펩타이드 합성효소 조립 라인의 사슬 종결 단계: 항생제 및 사이드로포어 생합성에서 아실-S-효소 분해 지시. ChemBioChem. (2001) 2:99–107. 도이: 10.1002/1439-7633(20010202)2:2<99::AID-CBIC99>3.0.CO;2-3
89. Kudo F, Eguchi T. aminoglycoside 항생제에 대한 생합성 유전자. J 항생제. (2009) 62:471–81. 도이: 10.1038/ja.2009.76
90. Park JW, Park SR, Nepal KK, Han AR, Ban YH, Yoo YJ, et al. 카나마이신 생합성의 병렬 경로 발견으로 항생제 조작이 가능해졌습니다. Nat Chem Biol. (2011) 7:843–52. 도이: 10.1038/nchembio.671
91. 반용화, 송MC, 황제이, 신H, 김형제, 홍SK 등 겐타마이신 B 생합성의 다양한 경로의 완전한 재구성. Nat Chem Biol. (2019) 15:295–303. 도이: 10.1038/s41589-018-0203-4
92. Narasimhan S, Rajeevan N, Liu L, Zhao YO, Heisig J, Pan J 등. 진드기 벡터 Ixodes scapularis의 장내 미생물군은 라임병 스피로헤타의 집락 형성을 조절합니다. 세포 숙주 미생물. (2014) 15:58–71. 도이: 10.1016/j.chom.2013.12.001
93. Johnston CW, Plumb J, Li X, Grinstein S, Magarvey NA. 정보 분석 결과 레지오넬라균이 새로운 천연 제품의 공급원으로 밝혀졌습니다. Synth Syst Biotechnol. (2016) 1:130–6. 도이: 10.1016/j.synbio.2015.12.001
94. 데위 RK. Suranto, Susilowati A, Wahyudi AT. 벼 필로스피어의 Xanthomonas oryzae pathovar oryzae에 대한 길항 세균의 16S rDNA 및 polyketide synthase 유전자의 분자 동정. 아시아 J 식물 Pathol. (2015) 9:148–57. 도이: 10.3923/ajppaj.2015.148.157
95. Walterson AM, Smith DDN, Stavrinides J. 항균성 천연 제품의 합성을 지시하는 Pantoea 생합성 클러스터의 식별. 플로스 원. (2014) 9:e96208. 도이: 10.1371/journal.pone.0096208
96. Jin M, Fischbach MA, Clardy J, A. 아세틸-CoA 카르복실라아제 억제제 andrimid에 대한 생합성 유전자 클러스터. J Am Chem Soc. (2006) 128:10660–1. 도이: 10.1021/ja063194c
97. Giltner CL, Nguyen Y, Burrows LL. 유형 IV 필린 단백질: 다목적 분자 모듈. Microbiol Mol Biol Rev. (2012) 76:740–72. 도이: 10.1128/MMBR.00035-12
98. Chauhan G, McClure J, Hekman J, Marsh PW, Bailey JA, Daniels RF 등. 시민 과학과 유전체학을 결합하여 진드기, 병원체 및 공생 미생물 군집을 단일 진드기 분해능으로 조사합니다. 프론트 제네. (2020) 10:1322. 도이: 10.3389/fgene.2019.01322
99. Telford SR, Dawson JE, Katavolos P, Warner CK, Kolbert CP, Persing DH. 사슴진드기-설치류 주기에서 인간 과립구 에를리히오시스(granulocytic ehrlichiosis) 인자의 지속. Proc Natl Acad Sci. (1996) 93:6209–14. 도이: 10.1073/pnas.93.12.6209
100. De Silva AM, Fikrig E. 수혈 중 Ixodes 진드기에서 Borrelia burgdorferi의 성장 및 이동. J Trop Med Hyg입니다. (1995) 53:397–404. 도이: 10.4269/ajtmh.1995.53.397
101. Grabowski JM, Kissinger R. Ixodid 진드기 해부 및 진드기 매개 바이러스 연구를 위한 생체 외 장기 배양 진드기. Curr Protoc Microbiol . (2020) 59:e118. 도이: 10.1002/cpmc.118
102. Cheng D, Vigil K, Schanes P, Brown RN, Zhong J. 실시간 정량적 PCR에 의한 캘리포니아 Ixodes pacificus의 두 가지 리케차 계통(G021 및 G022) 유병률 및 부담. 틱 틱 Borne Dis. (2013) 4:280–7. 도이: 10.1016/j.ttbdis.2012.12.005
103. Phan JN, Lu CR, Bender WG, Smoak RM, Zhong J. 캘리포니아 Ixodes pacificus에서 Rickettsia 종의 분자 검출 및 식별. 벡터 매개 Zoonotic Dis. (2011) 11:957–61. 도이: 10.1089/vbz.2010.0077
104. Diop A, El Karkouri K, Raoult D, Fournier PE. Rickettsia 속 종의 구분 및 정의를 위한 게놈 서열 기반 기준. Int J Syst Evol Microbiol. (2020) 70:1738–50. 도이: 10.1099/ijsem.0.003963
105. 레인 RS, 필립 RN, 캐스퍼 EA. 캘리포니아의 진드기 매개체의 생태. II. 리케차에 대한 추가 관찰. 에서: Burgdorfer W, Anacker R, 편집자. 리케차 및 리케차병. 뉴욕: 아카데믹 프레스. (1981) p. 575–584.
106. 휴즈 LE, 클리포드 CM, Gresbrink R, 토마스 LA, Keirans JE. 오레곤주에 있는 태평양 연안 진드기인 Ixodes pacificus에서 발견된 열병군 Rickettsia의 분리. J Trop Med Hyg입니다. (1976) 25:513–6. 도이: 10.4269/ajtmh.1976.25.513
107. Gauthier DT, Karpathy SE, Grizzard SL, Batra D, Rowe LA, Paddock CD. 서부검은다리진드기 Ixodes pacificus의 새로운 과도기군 Rickettsia 종(Rickettsia tillamookensis sp. nov)의 특성화. Int J Syst Evol Microbiol. (2021) 71:004880. 도이: 10.1099/ijsem.0.004880
108. Santanello C, Barwari R, Troyo A. 미주리에서 온 진드기에 있는 점박이열 그룹 Rickettsiae. 틱 틱 Borne Dis. (2018) 9:1395–9. 도이: 10.1016/j.ttbdis.2018.06.008
109. 해밀턴 PT, 펄만 SJ. Drosophila의 공생을 통한 숙주 방어. PLoS 파토그. (2013) 9:e1003808. 도이: 10.1371/journal.ppat.1003808
110. Weiss BL, Maltz M, Aksoy S. Obligate symbionts는 체체파리에서 면역 체계 발달을 활성화합니다. J Immunol. (2012) 188:3395–403. doi: 10.4049/jimmunol.1103691
111. 올리버 KM, 모란 NA, 헌터 MS. 진딧물에서 기생에 대한 저항성의 변화는 숙주 유전자형이 아닌 공생체에 기인한다. Proc Natl Acad Sci. (2005) 102:12795-800. 도이: 10.1073/pnas.0506131102
112. 니빌스키 ML, 피콕 MG, 슈완 TG. 진드기 벡터(Dermacentor andersoni)에 대한 Rickettsia rickettsii의 치명적인 영향. Appl Environ Microbiol. (1999) 65:773–8. 도이: 10.1128/AEM.65.2.773-778.1999
113. 슈마허 L, 스넬그로브 A, 레빈 ML. Rickettsia rickettsii(Rickettsiales: Rickettsiaceae) 감염이 생물학적 매개변수 및 진드기 벡터의 생존에 미치는 영향 - Dermacentor variabilis(Acari: Ixodidae). J Med Entomol. (2016) 53:172–6. 도이: 10.1093/jme/tjv166
Keywords: Ixodes scapularis , 진드기, Rickettsia , endosymbiont, 항생제, 간섭, 경쟁
인용: Cull B, Burkhardt NY, Wang XR, Thorpe CJ, Oliver JD, Kurtti TJ 및 Munderloh UG (2022) Ixodes scapularis Symbiont Rickettsia buchneri 는 진드기 세포에서 병원성 Rickettsiaceae의 성장을 억제합니다: 벡터 역량에 대한 시사점. 앞쪽. 수의사. 과학. 8:748427. 도이: 10.3389/fvets.2021.748427
수신: 2021년 7월 27일; 수락: 2021년 11월 22일;
게시일: 2022년 1월 6일.
검토자:
Jacob Lorenzo-Morales , University of La Laguna, 스페인Philip E. Stewart , Rocky Mountain Laboratories, National Institute of Allergy and Infectious Diseases, National Institutes of Health(NIH), 미국
저작권 © 2022 Cull, Burkhardt, Wang, Thorpe, Oliver, Kurtti 및 Munderloh. 이것은 Creative Commons Attribution License(CC BY) 의 조건에 따라 배포되는 오픈 액세스 기사입니다 . 다른 포럼에서의 사용, 배포 또는 복제는 승인된 학술 관행에 따라 원저자 및 저작권 소유자의 이름을 밝히고 이 저널의 원본 간행물을 인용하는 경우 허용됩니다. 본 약관을 준수하지 않는 사용, 배포 또는 복제는 허용되지 않습니다.
*답변: Benjamin Cull, cull0122@umn.edu
면책 조항: 이 기사에 표현된 모든 주장은 전적으로 저자의 주장이며 반드시 소속 기관이나 발행인, 편집자 및 검토자의 주장을 대변하지는 않습니다. 이 문서에서 평가할 수 있는 모든 제품이나 해당 제조업체가 주장할 수 있는 주장은 게시자가 보증하거나 보증하지 않습니다.
'생명공학' 카테고리의 다른 글
| 의생명과학 대학원 (1) | 2023.09.22 |
|---|---|
| 존스홉킨스대학교 - 화학 및 분자 생물학, 박사 (0) | 2023.08.30 |
| biological science (0) | 2023.07.03 |
| 생명 과학 문헌 (0) | 2023.04.06 |
| 생화학 (Biochemistry) (0) | 2023.04.03 |


