화학 철학 - Philosophy of Chemistry
First published Mon Mar 14, 2011; substantive revision Wed Jan 16, 2019
화학은 물질의 구조와 변형을 연구하는 학문입니다. 아리스토텔레스가 기원전 4 세기 에 화학에 관한 최초의 체계적인 논문을 썼을 때 , 물질의 본성에 대한 그의 개념적 이해는 비교적 단순한 범위의 관찰 가능한 현상을 수용하도록 조정되었습니다. 21 세기 에 화학은 가장 큰 과학 분야가 되었으며 직접적인 경험적 조사에서 실질적인 이론적 연구에 이르기까지 연간 50만 건 이상의 출판물을 생산했습니다. 그러나 화학에서 발생하는 개념적 문제에 대한 전문적인 관심(이하 화학 철학)은 과학 철학에 비교적 최근에 추가된 것입니다.
화학 철학은 크게 두 부분으로 나뉩니다. 첫째, 화학 내에서 발생하는 개념적 문제를 주의 깊게 표현하고 분석합니다. 화학에 내재된 그러한 질문에는 물질의 본성, 원자론, 화학 결합 및 합성이 포함됩니다. 둘째, 사실주의, 환원, 설명, 확인, 모델링과 같은 과학철학의 전통적인 주제를 화학의 맥락에서 다룬다.
- 1. 물질, 원소 및 화학적 조합
- 2. 원자론
- 3. 화학 혁명
- 4. 화학의 구조
- 5. 메커니즘 및 합성
- 6. 화학적 환원
- 7. 모델링 및 화학적 설명
- 서지
- 학업 도구
- 기타 인터넷 리소스
- 관련 항목
1. 물질, 원소 및 화학적 조합
화학 물질에 대한 우리의 현대적 이해는 원소 및 원자입니다. 모든 물질은 수소 및 산소와 같은 원소의 원자로 구성됩니다. 이 원자는 화합물의 미세 구조의 빌딩 블록이므로 화학 분석의 기본 단위입니다. 그러나 화학 원자의 실체는 20세기 초까지만 해도 논란의 여지가 있었고 " 기본 빌딩 블록"이라는 문구는 항상 신중한 해석이 필요했습니다. 그래서 오늘날에도 모든 실체는 원소로 구성되어 있다는 주장은 원소의 존재론적 지위와 원소가 어떻게 개별화되어야 하는지에 대한 충분한 지침을 주지 못하고 있다.
이 섹션에서는 요소 문제로 시작합니다. 역사적으로 화학자들은 "무언가가 원소가 된다는 것은 무엇인가?"라는 질문에 대해 두 가지 답을 제시했습니다.
- 원소는 고립된 상태로 존재할 수 있고 더 이상 분석할 수 없는 물질이다(이하 분석 논문 끝 ).
- 원소는 복합물질(이하 실성분 론)의 구성성분인 물질이다.
이 두 논문은 요소를 서로 다른 방식으로 설명합니다. 첫 번째에서 요소는 프로시저에 의해 명시적으로 식별됩니다. 원소는 더 이상 분리할 수 없는 혼합물의 성분일 뿐입니다. 두 번째 개념은 더 이론적인 것으로 요소를 복합체의 구성 요소로 간주합니다. 전근대 아리스토텔레스 체계에서 분석 논문의 끝은 선호되는 선택이었습니다. 아리스토텔레스는 원소가 화학 물질의 구성 요소이며 이러한 물질에만 잠재적으로 존재한다고 믿었습니다. 요소에 대한 현대적 개념은 비록 우리가 보게 되겠지만 분석 논문의 끝 부분이 남아 있지만 실제 구성 요소라고 주장합니다. 이 섹션에서는 한 개념에서 다른 개념으로 화학이 발전하는 이면에 있는 개념적 배경을 설명합니다. 길을 따라,
1.1 아리스토텔레스의 화학
물질과 물질의 변형에 관한 최초의 개념적 분석은 아리스토텔레스의 전통에 있습니다. 현대 화학에서와 마찬가지로 아리스토텔레스 이론의 초점은 물질의 본성과 물질의 변형이었습니다. 그는 On Generation and Corruption ( De Generatione et Corruptione ), Meteorology , Physics 와 On On Heavens ( De Caelo )의 일부에서 화학 이론의 첫 번째 체계적인 논문을 제공했습니다.
아리스토텔레스는 비록 그 중 일부는 하나의 순수한 물질로 구성될 수 있다고 생각했지만 대부분의 평범한 물질적 사물은 여러 물질로 구성되어 있음을 인식했습니다. 따라서 그는 단일 물질을 개별화할 순도의 기준을 제시해야 했습니다. 그의 기준은 순수한 물질은 동질체라 는 것이었습니다 . 즉, 모든 수준에서 같은 부분으로 구성되어 있습니다. "[I] 결합이 발생했다면, 화합물 은 균일 해야 합니다 . 그러한 화합물의 일부는 전체와 동일하며, 물의 일부가 물인 것과 같습니다."( De Generatione et Corruptione , 이후 DG , I.10 , 328a10ff). [ 1 ]그래서 암석 속의 다이아몬드, 물 속의 기름, 공기 속의 연기를 만날 때 아리스토텔레스의 화학은 우리에게 하나 이상의 물질이 존재한다고 말합니다.
그의 전임자들 중 일부와 마찬가지로 아리스토텔레스는 불, 물, 공기 및 흙이 모든 물질의 구성 요소라고 주장했습니다. 그러나 그의 전임자들과 달리 아리스토텔레스는 이 목록을 기본 원칙에서 설정했습니다. 그는 “같은 것이 뜨겁고 차가우며 습하고 건조한 것은 불가능하다… 불은 뜨겁고 건조하지만 공기는 뜨겁고 습하다… 그리고 물은 차갑고 습하지만 지구는 차갑고 건조하다”( DG II.3, 330a30-330b5). 아리스토텔레스는 덥고 습한 것을 열과 습도의 최대 수준으로, 춥고 건조한 수준을 최소 수준으로 가정했습니다. 비 원소 물질은 따뜻함과 습도의 주요 특성의 중간 정도가 특징입니다.
아리스토텔레스는 이 원소 이론을 사용하여 물질의 많은 특성을 설명했습니다. 예를 들어 그는 요소의 두 가지 특성인 습윤과 건조에 의해 부과되는 다른 특성에 주목함으로써 액체와 고체를 구별했습니다. “[M]oist는 형태가 쉽게 적응할 수 있고 그 자체의 한계에 의해 결정될 수 없는 것입니다. 건조는 그 자체의 한계에 의해 쉽게 결정될 수 있지만 모양에 있어서는 쉽게 적응할 수 없는 것입니다.”( DGII.2, 329b30f.). 고체는 모양과 부피가 있고 액체는 부피만 있습니다. 그는 액체와 자체 부피조차 없는 기체를 더 구별했습니다. 그는 물과 공기가 모두 습하기 때문에 유동성이 있는 반면, 차갑게는 물을 액체로 만들고 뜨거운 것은 공기를 기체로 만든다고 추론했습니다. 반면에 건조함은 추위와 함께 흙을 단단하게 하지만 더위와 함께 우리는 불을 얻습니다.
화학은 물질의 구성 요소 그 이상에 중점을 둡니다. 즉, 물질을 다른 종류의 물질로 바꾸는 변형을 설명하려고 합니다. 아리스토텔레스는 또한 한 물질이 다른 물질을 압도하고 제거하는 변환 과 적절한 혼합 을 구별하여 이 과정의 첫 번째 중요한 분석에 기여했습니다 . 전자는 우리가 현재 상 변화라고 부르는 것과 가장 가깝고 후자는 우리가 지금 화학적 조합이라고 부르는 것에 가깝습니다.
아리스토텔레스는 비슷한 양의 물질이 모여서 '화합물'이라는 다른 물질이 생성될 때 적절한 혼합이 일어날 수 있다고 생각했습니다. [ 2 ] 따라서 우리가 일반적으로 접하는 물질은 화합물이며, 모든 화합물은 그것을 만들 수 있는 몇 가지 성분이 있다는 특징이 있습니다.
원래 성분이 함께 혼합되어 화합물을 형성할 때 원래 성분은 어떻게 됩니까? 현대 화학자들과 마찬가지로 아리스토텔레스는 원래 성분이 적어도 원칙적으로는 추가 변형을 통해 얻을 수 있다고 주장했습니다. 그는 바닷물에서 소금과 물을 얻을 수 있고 합금에서 금속을 얻을 수 있다는 것을 알고 있었을 것입니다. 그러나 그는 관찰의 상세한 목록이 아니라 개념적 논증으로 이것을 설명합니다.
아리스토텔레스는 먼저 이질 혼합물이 분해될 수 있다고 주장합니다.
관찰에 따르면 혼합체도 종종 동종체로 나눌 수 있습니다. 예로는 살, 뼈, 나무 및 돌이 있습니다. 그 이후로 합성물은 요소가 될 수 없으며 모든 동종체가 요소가 될 수는 없습니다. 우리가 전에 말했듯이, 형태가 다른 몸체로 나눌 수 없는 것( De caelo , III.4, 302b15-20).
그런 다음 그는 특히 분석에서의 회복을 언급하면서 단순체의 관점에서 요소의 개념에 대한 명시적인 정의를 제공합니다.
요소는 다른 물체가 분석될 수 있는 물체이며 잠재적으로 또는 실제로 존재하며(이 중 어느 것이 여전히 논쟁의 여지가 있음) 형태가 다른 물체로 나눌 수 없습니다. 그것 또는 이와 유사한 것은 모든 경우에 모든 사람이 요소로 의미하는 것입니다( De caelo , III.3, 302a15ff).
여기에 함축된 단순성 개념은 DG 후반부에 도입되었으며 아리스토텔레스는 책 II에서 "모든 복합체는 … 모든 단순체로 구성됩니다"(334b31)라고 주장합니다. 그러나 모든 단순체(원소)가 모든 화합물에 존재한다면 다양한 화합물은 어떻게 구별됩니까? 보다 최근의 화학을 살펴보면, 서로 다른 물질을 특징짓는 기본 특성인 따뜻함과 습도의 정도가 서로 다른 비율의 요소가 혼합되어 발생한다고 생각하는 것이 당연합니다. 아마도 아리스토텔레스는 "부분은 전체와 그 구성 요소 사이에 동일한 비율을 나타낸다"( DG I.10, 328a8-9) 라고 말함으로써 혼합 제품의 균일성을 표현할 때 이 아이디어를 잠시 언급할 것입니다. DG 에서II.7, 334b15).
그러나 "요소의 비율"은 무엇을 의미합니까? 상수 및 배수 비율의 현대 법칙은 질량 개념에 기초하여 이해되는 요소 비율의 개념을 다룹니다. 아리스토텔레스에게는 그러한 개념이 없었습니다. 현존하는 텍스트는 아리스토텔레스가 원소 비율의 개념을 이해했을 수 있는 방법에 대한 거의 표시를 제공하지 않으며 우리는 추측에 의존해야 합니다(Needham 2009a).
그가 원소 비율을 어떻게 이해했는지에 관계없이, 아리스토텔레스는 회수할 수 있지만 원소가 실제로 화합물에 존재하지 않는다는 것을 아주 분명하게 밝혔습니다. DG I.10 에서 그는 원래 성분이 혼합 과정의 결과 화합물에 실제로 존재하지 않고 잠재적으로만 존재한다고 주장합니다.
아리스토텔레스의 이론에서 원소가 실제로 화합물에 존재하지 않는 데에는 두 가지 이유가 있습니다. 첫 번째는 혼합이 발생하는 방식에 관한 것입니다. 혼합은 다른 물질에 영향을 미치고 영향을 받는 물질의 1차적인 능력과 감수성 때문에 발생합니다. 이것은 새로운 화합물이 형성될 때 원래의 모든 물질이 변경됨 을 의미합니다. 아리스토텔레스는 반대되는 반대가 중화되고 중간 상태가 생성될 때 화합물이 형성된다고 말합니다.
뜨거운 것과 차가운 것에는 정도의 차이가 있기 때문에 … [그때] 둘 다 결합하여 서로의 과잉을 파괴하여 대신에 (뜨거운 것) 차가운 뜨거운 것과 (추위에 대한) 뜨거운 감기가 존재하도록 합니다. 그러면 … 중간이 존재할 것입니다. … 그러므로 … 그런즉 … 원소에서 살과 뼈 등이 생겨나는데, 그것들이 중용에 이르면 더움이 차게 되고 더움이 더워지느니라. 왜냐하면 평균은 뜨겁지도 차갑지도 않기 때문입니다. 그러나 평균은 상당한 정도이며 나눌 수 없습니다. 유사하게, 건조하고 습하고 나머지가 살과 뼈와 나머지 화합물을 생산하는 것은 비열한 조건 때문입니다. ( DG II.7, 334b8–30)
두 번째 이유는 순수한 물질의 균질성 요구 사항과 관련이 있습니다. 아리스토텔레스는 "만약 결합이 일어나면 화합물 은 균일 해야 합니다 . 물의 어느 부분이 물인 것과 마찬가지로 그러한 화합물의 어떤 부분도 전체와 동일해야 합니다."라고 말합니다 . 요소는 극한의 따뜻함과 습도로 정의되므로 이러한 특성이 중간 정도인 것은 요소가 아닙니다. 균질하기 때문에 화합물의 모든 부분은 이러한 품질의 중간 정도가 동일합니다. 따라서 극도의 특성을 가진 부품이 없으므로 실제로 존재하는 요소가 없습니다. 따라서 새로운 물질의 출현에 대한 그의 이론은 원소가 실제로 화합물에 존재하지 않는다는 것을 의미합니다.
그래서 우리는 흥미로운 이론적 교착 상태에 도달합니다. 아리스토텔레스는 원소를 개별적으로 나타내는 조건으로 정의하고 모든 화합물은 원소로 구성되어 있다고 주장했습니다. 그러나 요소가 개별적으로 가지고 있는 속성은 실제로 존재하는 화합물의 어떤 부분도 가질 수 있는 것이 아닙니다. 그렇다면 어떻게 요소를 복구할 수 있습니까?
아리스토텔레스의 이론에서 화합물이 원소로 해리되도록 유도하는 것이 무엇인지 이해하는 것은 확실히 쉽지 않습니다. 압도적인 종류의 믹싱 프로세스는 적용되지 않는 것 같습니다. 예를 들어 바닷물에서 소금과 물이 분리되는 것을 어떻게 설명할 수 있습니까? 그러나 요소의 실제 존재를 옹호하는 사람들의 문제는 고립된 상태와 결합된 상태 모두 에서 나타나는 속성의 관점에서 요소를 특성화하는 것입니다 . 잠재적 존재 또는 실제 존재 관점을 방어하기 위해 이 도전을 적절하게 충족시키는 일반적인 문제 는 혼합 의 문제입니다 (Cooper 2004; Fine 1995, Wood & Weisberg 2004).
요약하면, 아리스토텔레스는 원소, 순수 물질 및 화학 조합에 대한 이후의 모든 논의를 위한 철학적 토대를 마련했습니다. 그는 모든 순수한 물질은 동질체이며 공기, 흙, 불, 물로 구성되어 있다고 주장했습니다. 이러한 요소는 이러한 물질에 실제로 존재하지 않았습니다. 오히려 네 가지 요소가 잠재적으로 존재했습니다. 그들의 잠재적인 존재는 추가 분석과 변형을 통해 드러날 수 있습니다.
1.2 라부아지에의 원소
앙투안 라부아지에(Antoine Lavoisier, 1743-1794)는 종종 현대 화학의 아버지라고 불리며 1789년까지 그는 현대 화학자가 인식할 원소 목록을 작성했습니다. 그러나 Lavoisier의 목록은 우리의 현대 목록과 동일하지 않았습니다. 현재 우리는 수소와 산소를 원소로, 그 기체를 분자로 간주한다는 것을 알고 있지만, 수소 및 산소 가스와 같은 일부 항목은 Lavoisier에 의해 화합물로 간주되었습니다.
그의 목록에 있는 다른 항목은 현대 시스템에서 전혀 자리를 차지하지 않는 아리스토텔레스 시스템의 잔재였습니다. 예를 들어, 열량의 다소 변형된 형태에도 불구하고 불은 그의 목록에 남아 있었습니다. 공기는 산소라고 불리는 호흡 가능한 부분과 아조산염 또는 질소라고 불리는 나머지 부분으로 분석됩니다. 그의 목록에는 석회, 마그네시아, 중정석 및 아가미의 네 가지 유형의 지구가 있습니다. 이 지구의 구성은 "전혀 알려지지 않았으며, 새로운 발견에 의해 구성 요소가 확인될 때까지 우리는 그것들을 단순한 물체로 간주할 권한이 확실히 부여되었습니다"(1789, p. 157). 그러나 Lavoisier는 계속해서 "모든 것이 우리가 지구라고 부르는 물질은 단지 금속성 산화물일 수 있습니다”(1789, p. 159).
Lavoisier의 시스템에서 특히 중요한 것은 특정 화합물의 원소 기반이 어떻게 결정되는지에 대한 그의 논의입니다. 예를 들어, 그는 물이 어떻게 수소와 산소의 화합물로 나타날 수 있는지 설명합니다(1789, pp. 83–96). 그는 다음과 같이 씁니다.
16온스의 알코올이 연소 중에 분리된 모든 물을 모으기 위해 적절하게 조정된 장치에서 연소될 때 17에서 18온스의 물을 얻습니다. 어떤 물질도 원래의 부피보다 더 큰 제품을 제공할 수 없기 때문에 연소 중에 다른 것이 알코올과 결합하게 됩니다. 그리고 나는 이것이 산소, 즉 공기의 기초임에 틀림없다는 것을 이미 보여주었습니다. 따라서 알코올에는 물의 요소 중 하나인 수소가 포함되어 있습니다. 그리고 대기는 산소를 포함하는데, 이는 물의 구성에 필요한 또 다른 요소입니다(1789, p. 96).
여기서 요구되는 물질 보존의 형이상학적 원리(물질은 화학적 과정에서 생성되거나 파괴될 수 없음)는 적어도 아리스토텔레스만큼 오래되었습니다(Weisheipl 1963). 이 구절이 설명하는 것은 보존의 기준인 질량의 보존을 사용하는 것입니다. 생성물의 총 질량은 반응물의 질량에서 나와야 하며, 이것이 쉽게 보이는 것에서 발견되지 않으면 다른 덜 쉽게 보이는 반응물이 있어야 합니다.
이 원칙을 통해 Lavoisier는 본질적으로 아리스토텔레스의 단순 물질 개념(302a15ff., 섹션 1.1에서 인용)을 훨씬 더 효과적인 실험적 사용에 적용할 수 있었습니다. 원자 이론을 거부한 직후 그는 “만약 우리가 원소 또는 물체의 원리 라는 용어를 적용한다면, 분석이 도달할 수 있는 마지막 지점에 대한 우리의 관념을 표현하기 위해, 우리는 우리가 어떤 방법으로든 분해에 의해 신체를 환원시킬 수 있는 모든 물질을 요소로서 인정해야 합니다.”(1789, p. xxiv). 즉, 원소는 우리가 실험적으로 생성할 수 있는 물질의 가장 작은 구성 요소로 식별됩니다. 질량 보존의 원리는 화학 변화가 보다 단순한 물질로 분해되는 경우의 기준을 제공하여 플로지스톤 이론을 폐기하는 데 결정적인 역할을 했습니다. 하소 시 중량 증가는 이 원리에 비추어 볼 때 플로지스톤 이론가들이 생각하는 것처럼 하소는 분해가 아니라 더 복잡한 화합물의 형성을 의미합니다.
이 정의의 실용적인 성격에도 불구하고, Lavoisier는 산소 가스의 분해를 필요로 하는 금속 산화물의 형성뿐만 아니라 지구의 복합 성질에 대해 자유롭게 추측했습니다. 따라서 Lavoisier는 또한 요소의 개념을 이론적인 분석 개념의 마지막 지점으로 발전시켰습니다. 분석 개념의 이 마지막 지점은 아리스토텔레스와 마찬가지로 라부아지에에게도 중요한 개념으로 남아 있었지만 그의 개념은 아리스토텔레스보다 훨씬 더 발전했으며 19세기에 더 많은 이론적 발전을 위한 기초를 제공했습니다(Hendry 2005).
1.3 멘델레예프의 주기율표
Lavoisier의 원소 목록은 19세기에 많은 새로운 원소가 발견되면서 수정되고 정교해졌습니다. 예를 들어 Humphrey Davy(1778-1829)는 전기분해에 의해 나트륨과 칼륨을 분리하여 Lavoisier의 지구가 실제로 화합물임을 입증했습니다. 또한 1840년대 열역학 제1법칙이 발견되면서 열량은 허용되는 원소 목록에서 사라졌습니다. 따라서 이러한 변화하지만 증가하는 요소 수와 함께 화학자들은 체계화의 필요성을 점점 더 인식하게 되었습니다. 많은 시도가 있었지만 존 뉴랜즈(John Newlands, 1837~98)가 최초의 주기율표를 작성하여 당시 알려진 63개 원소 중 62개가 "옥타브" 규칙을 따른다는 것을 보여주는 초기의 영향력 있는 설명을 했습니다. .
나중에 Lothar Meyer(1830-95)와 Dmitrij Mendeleev(1834-1907)는 1869년에 알려진 모든 63개 원소를 포함하는 주기율표를 독립적으로 발표했습니다. 1871년 Mendeleev는 이후 찬사를 받은 형태로 주기율표를 출판했습니다. 이 표는 상대적 원자량으로 순차적으로 정렬될 때 요소가 뒤따르므로 주기적으로 반복되는 일반적인 특징에 대한 아이디어로 구성되었습니다. 주기적으로 반복되는 화학적 거동의 유사성은 요소를 그룹으로 구성하는 기초를 제공했습니다. 그는 12개의 수평 기간에 걸쳐 8개의 그룹을 식별했는데, 이는 그가 단지 63개의 요소로 작업한다는 점을 감안할 때 여러 개의 구멍이 있음을 의미한다는 것을 의미합니다.
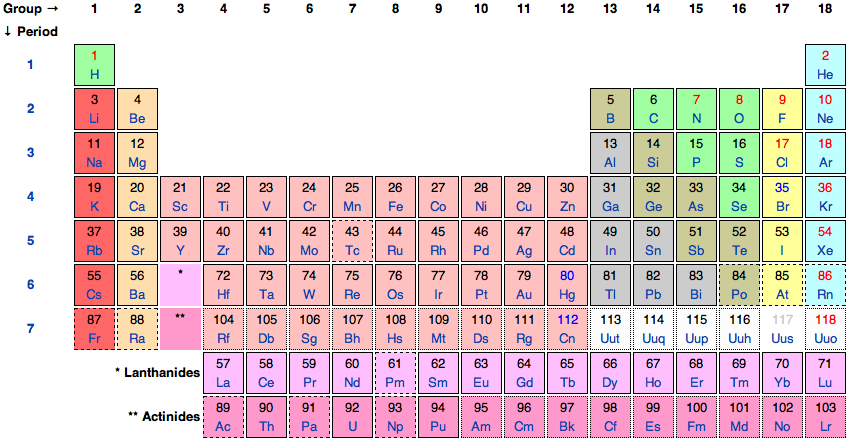
그림 1. 국제순수응용화학연맹의 원소 주기율표.
그림 1에 묘사된 현대 주기율표는 멘델레예프의 표를 기반으로 하지만 현재 92개의 자연 발생 요소와 수십 개의 인공 요소를 포함합니다(Scerri 2006 참조). 가장 가벼운 원소인 수소는 배치하기 어렵지만 일반적으로 첫 번째 그룹의 맨 위에 배치됩니다. 다음은 19 세기 말까지 발견되지 않은 희가스 중 가장 가벼운 헬륨입니다 . 그런 다음 두 번째 기간은 1족(알칼리 금속) 원소의 첫 번째인 리튬으로 시작됩니다. 두 번째 기간을 지나갈 때 연속적으로 더 무거운 원소는 헬륨과 같은 희가스인 네온에 도달할 때까지 다른 족의 첫 번째 구성원이 됩니다. 그런 다음 다음으로 무거운 원소인 나트륨을 가지고 1족 알칼리 금속으로 돌아가서 세 번째 기간을 시작하는 식으로 계속됩니다.
그의 체계화에 기초하여 Mendeleev는 알려진 특정 원소의 원자량 값을 수정할 수 있었고 또한 주기율표의 간격에 해당하는 당시 알려지지 않은 원소의 존재를 예측할 수 있었습니다. 그의 시스템은 1875년 Lecoq de Boisbaudran(1838-1912)이 새로 발견한 원소인 갈륨이 eka-aluminium이라는 이름으로 그가 예측한 원소와 동일하다는 사실을 지적하면서 처음으로 심각하게 주목받기 시작했습니다. 밀도는 Lecoq de Boisbaudran이 보고한 값보다 상당히 커야 합니다. 측정을 반복하여 Mendeleev가 옳았다는 것이 증명되었습니다. 1879년 스칸듐의 발견과 1886년 게르마늄의 발견은 Mendeleev가 "eka-bor" 및 "eka-silicon"이라고 부른 것에 대해 예측한 특성을 가진 추가 승리였습니다(Scerri 2006).
현대 화학에서 사용되는 요소의 체계화를 제공하는 것 외에도 Mendeleev는 현대 철학적 이해를 알려주는 요소의 특성에 대한 설명도 제공했습니다. 그는 분석의 끝과 원소의 실성분 개념을 명확히 구분하고 두 개념이 화학적으로 중요하다고 생각하면서 주기율표를 구성할 때 실성분 이론에 의존했다. 그는 원소가 화합물에 남아 있고 화합물의 무게는 구성 원자의 무게의 합이라고 가정했습니다. 따라서 그는 원자량을 주기율표의 주요 정렬 속성으로 사용할 수 있었습니다. [ 3 ]
오늘날, 원소의 정의를 포함한 화학 명명법은 국제순수응용화학연맹(IUPAC)에 의해 규제됩니다. 1923년 IUPAC는 Mendeleev를 따랐고 실제 구성 요소 테제를 명시적으로 승인하여 요소에 대한 개별화 기준을 표준화했습니다. 그들이 Mendeleev와 다른 점은 요소를 가장 잘 개별화할 수 있다고 생각한 속성입니다. 원자량을 사용하지 않고 원자 번호 , 양성자 및 중성 원소 원자의 전자 수 에 따라 원소를 정렬하여 동위 원소 의 발생을 허용했습니다.원자번호는 같지만 원자량은 다르다. 그들은 전자 구조가 원자가 결합하여 분자를 형성하는 방식을 결정하는 원자의 특징이며 전자의 수는 전반적인 전기적 중성의 요구 사항에 의해 결정된다는 인식이 커지면서 원자 번호로 원소를 정렬하기로 결정했습니다(Kragh 2000).
1.4 주기율표의 합병증
멘델레예프의 주기율표는 1894년 불활성 가스 아르곤의 발견으로 잠시 의문을 제기했는데, 이는 염소 다음으로 기존 시스템 외부에 배치되어야 했습니다. 그러나 William Ramsay(1852-1916)는 전기음성 할로겐 17족(염소가 속함)과 전기양성 알칼리 금속을 분리하는 화학적으로 불활성인 물질의 전체 그룹이 있을 수 있다고 의심했으며 1898년까지 그는 다른 희가스를 발견했습니다. 현대 테이블의 그룹 18.
더 심각한 문제는 1913년 영국의 방사성 화학자 Frederick Soddy(1877~1956)가 원자량 동일성 기준에 따라 주기율표의 위치가 여러 원소로 채워져 있다는 사실을 확립했을 때 발생했습니다. 마가렛 토드(Margaret Todd, 1859-1918)의 제안을 받아들여 소디는 이 원소들을 "같은 장소"를 의미하는 '동위원소'라고 불렀습니다. 동시에 원자가 훨씬 더 가벼운 전자가 순환하는 양전하를 띤 핵으로 구성되어 있다는 보어의 개념이 받아들여지고 있었습니다. 기준에 대한 약간의 논의(van der Vet 1979) 후에, 1923년 IUPAC 회의의 대표자들은 위치가 원자량보다는 원자 번호(핵의 양성자 수)와 관련되어야 한다고 결정함으로써 주기율표를 저장했습니다.
주기율표의 위치와 정수의 상관 관계는 최종적으로 알려진 가장 높은 원자 번호에 해당하는 위치 아래의 표에 공백이 남아 있는지 여부를 결정하는 기준을 제공했습니다. 고정된 원자 번호에 대한 원자량의 변화는 1932년 James Chadwick(1891-1974)이 중성자를 발견했을 때 설명되었습니다. 중성자는 양성자와 거의 같은 질량을 가진 원자핵에서 양성자와 함께 발생하는 중성 입자입니다.
요소의 본질에 대한 현대 철학적 논의는 IUPAC 표준과 정의에 큰 영향을 미친 프리드리히 파네트(Friedrich Paneth, 1887-1958)의 작업으로 시작됩니다. 그는 근대 최초의 화학자 중 한 사람으로 마지막 분석 시점과 실제 성분 분석을 명확히 구분했으며, 분석 논문의 마지막 시점은 화합물의 성질에 대한 화학적 설명의 적절한 근거가 될 수 없다고 주장했다. 물질에 실제로 존재하지 않는 것은 실제 물질의 속성을 설명하기 위해 호출될 수 없습니다. 그는 원소의 화학적으로 중요한 개념이 "초월적"이라고 말했으며, 이는 "화합물의 특성에 대한 추상화"를 의미하는 것으로 해석됩니다(Panet 1962).
현대 IUPAC 요소 정의에서 철학적 토론의 또 다른 가닥. IUPAC에 따르면 금은 원자량에 관계없이 원자 번호 79를 갖는 것입니다. 이 정의의 논리적이고 의도된 결과는 원자 번호를 공유하는 모든 동위원소가 동일한 요소로 간주된다는 것입니다. Needham(2008)은 최근 동위원소 간의 화학적으로 현저한 차이를 지적함으로써 이 확인에 도전했습니다. 이러한 차이점은 수소의 세 가지 동위 원소인 protium, deuterium 및 tritium에 의해 가장 잘 설명됩니다. 수소의 동위원소 중 가장 두드러진 화학적 차이점은 서로 다른 화학 반응 속도입니다. 생화학적 과정이 반응 속도에 민감하기 때문에 중수(산화 중수소)는 독성이 있는 반면 일반 물(주로 산화 프로튬)은 독성이 없습니다. 보다 민감한 측정 기술의 발달로 이것이 일반적인 현상이라는 것이 분명해졌습니다. 동위원소 변화는 화학 반응의 속도에 영향을 주지만 이러한 효과는 원자 번호가 증가함에 따라 덜 두드러집니다. 화학자들이 이러한 행동의 차이를 이해하는 방식의 관점에서 Needham은 이것이 화학 물질의 차이의 기초가 된다고 합리적으로 말할 수 있다고 주장합니다. 그는 또한 열역학에 의해 제공되는 동일성과 차이점의 기준이 동위원소가 다른 물질로 간주되어야 함을 시사한다고 주장합니다. 그러나 그의 자신의 견해에도 불구하고 Mendeleev의 주기율표에서 위치는 원자 번호(또는 핵 전하)에 의해 결정되므로 원자량에 대한 집중은 화학 분류의 고도로 수정된 것입니다(Hendry 2006a).
1.5 혼합물과 화합물에 대한 현대적 문제
현대의 화학 결합 이론은 적절한 혼합에 대한 고대 이론과 수백 년에 걸친 실험 작업의 융합에서 생겨났습니다. 그러나 Lavoisier가 현대 화학을 시작했을 때조차도 화학자들은 원소가 결합하여 화합물을 형성하는 방법을 제어하는 규칙이나 원칙을 거의 갖고 있지 않았습니다. 이 섹션에서는 그러한 기준을 제공하기 위한 이론적 노력에 대해 논의합니다.
화학 결합 이론을 향한 첫 번째 단계는 물에 대한 Lavoisier의 신중한 실험 작업에 내포되어 있습니다. 그의 화학 원소 에서 Lavoisier는 물을 원소로 완전히 환원시켜 얻은 수소와 산소의 질량 비율을 설정했습니다. 그의 결과가 이 실험을 여러 번 반복한 결과라는 사실은 그가 물과 같은 화합물이 항상 동일한 비율로 동일한 원소로 구성되어 있다고 가정했음을 시사합니다. 화합물에서 원소의 불변 비율에 대한 이 널리 공유된 견해는 처음 에 불변 비율의 법칙 으로 명시적으로 선언되었습니다.19세기 초에 Joseph Louis Proust(1754-1826)에 의해 프루스트는 라부아지에의 동료이자 지지자 중 한 명인 클로드 루이 베르톨레(Claude Louis Berthollet, 1748-1822)에 대한 반응으로 그렇게 했습니다. 그는 화합물은 원소 조성이 다를 수 있다고 주장했습니다.
비록 주로 이론적이고 개념적인 가정이지만, 일정 비율의 법칙은 화학 분석을 위한 중요한 도구가 되었습니다. 예를 들어, 화학자들은 대기의 공기가 질소와 산소로 구성되어 있으며 원소가 아니라는 것을 이해하게 되었습니다. 그러나 공기는 이러한 원소들의 진정한 화합물인가 아니면 다른 시간과 다른 장소에서 변할 수 있는 질소와 산소의 느슨한 혼합물인가? 일정한 비율의 법칙은 화합물과 순수한 혼합물을 구별하는 기준을 제공했습니다. 공기가 화합물이라면 질소와 산소의 비율은 항상 같을 것이며 아산화질소와 같은 질소와 산소의 다른 화합물과 더 구별할 수 있어야 합니다. 공기가 진짜 화합물이 아니었다면, 그것은 해결책 의 한 예가 될 것입니다., 비율이 다를 수 있는 산소와 질소의 균질한 혼합물.
Berthollet은 용액과 화합물 사이의 이러한 엄격한 구분을 받아들이지 않았습니다. 그는 물질이 다른 물질과 접촉할 때마다 물질을 더 추가하면 결합이 과도하게 남을 때까지 균질한 결합을 형성한다고 믿었습니다. 예를 들어, 물과 설탕이 결합되면 처음에는 균질한 결합을 형성합니다. 특정 시점에서 서로에 대한 물과 설탕의 친화력은 포화되고 더 많은 설탕을 추가하면 고체 설탕의 두 번째 단계가 형성됩니다. 이 포화점은 용액의 압력과 온도에 따라 달라집니다. Berthollet은 포화 용액에 있는 설탕의 양이 온도와 압력에 따라 달라지는 것처럼 화합물의 원소 비율은 주변 조건에 민감하다고 주장했습니다. 따라서 그는 다음과 같이 주장했다. 물질이 항상 동일한 비율의 원소로 구성되어 있고 이것이 일정 비율의 법칙을 훼손한다는 것은 사실이 아닙니다. 그러나 오랜 논쟁 끝에 화학자들은 프루스트가 제시한 증거가 화합물에 대한 일정 비율의 법칙을 확립했다는 사실을 받아들이게 되었고, 이로써 용액과 구별되었습니다.
화학자들의 관심은 19세기 전반부의 화합물 연구에 주로 집중되었는데, 처음에는 프루스트가 제공한 증거 기반을 넓히려는 목적이었습니다. 한동안 불변비의 법칙은 화학 결합의 발생에 대한 만족스러운 기준처럼 보였습니다. 그러나 19세기 말에 이르러 화학자들은 해결책에 관심을 돌렸습니다. 해법에 대한 그들의 연구는 물질이 접촉할 때 겪는 상태 변화가 에너지와 엔트로피를 지배하는 법칙에 종속된다고 말하는 열역학의 새로운 과학에 기초했습니다.
열역학은 화합물과 용액 사이에 명확한 구분을 제공하지 않았지만 이상적인 솔루션 이라는 특수한 경우에 대한 개념의 공식화를 허용했습니다.. 분리된 성분에 비해 안정성이 높아진 것은 전적으로 혼합의 엔트로피에 기인하기 때문에 이상적인 솔루션이 형성됩니다. 이것은 순전히 기계적 혼합물이라는 개념의 정확성으로 이해될 수 있습니다. 대조적으로, 화합물은 혼합 엔트로피 이상으로 구성 성분 간의 상호 작용에 의해 안정화되었습니다. 예를 들어, 고체 염화나트륨은 염화나트륨을 형성하기 위해 반응하는 나트륨과 염소의 상호작용에 의해 안정화됩니다. 실제 솔루션의 동작은 이상적인 솔루션의 동작과 비교할 수 있으며, 비이상이 예외가 아니라 규칙이라는 것이 밝혀졌습니다. 이상은 특정 희석 바이너리 솔루션에서만 접근합니다. 더 자주, 솔루션은 구성 요소 간의 중요한 화학적 상호 작용 측면에서만 이해할 수 있는 동작을 나타냅니다.
그의 사후 20세기 초반에 Berthollet은 현재 우리가 Berthollides라고 부르는 물질 종류의 신중한 특성을 통해 부분적으로 입증되었습니다. 이들은 요소의 비율이 서로 간단한 관계에 있지 않은 화합물입니다. 원소 비율은 고정되어 있지 않고 온도와 압력에 따라 변합니다. 예를 들어, 광물 wüstite 또는 산화제1철은 대략 FeO의 조성식을 갖지만 일반적으로 산소보다 철이 다소 적습니다.
순전히 거시적인 열역학적 관점에서 베르톨리드는 온도와 압력의 함수로서 에너지와 엔트로피의 상호작용을 수용하는 깁스 자유 에너지라고 하는 열역학적 함수의 최소화로 이해될 수 있습니다. 안정 물질은 깁스 자유 에너지가 최소인 물질입니다. 미시적 규모에서 산화철의 기본 미세구조는 철(Fe 2+ )과 산화물(O 2- )의 3차원 격자입니다.) 이온. 그러나 일부 철 이온은 결정 격자에 무작위로 분포된 정공으로 대체되어 균일한 결정 구조에 비해 엔트로피가 증가합니다. 전하의 전반적인 불균형은 누락된 이온에 의해 생성됩니다. 그러나 이것은 제2철(Fe 3+ ) 로 전환되는 나머지 이온 수의 두 배에 의해 산화제1철에서 상쇄됩니다.이온. 이러한 전자의 제거는 에너지 입력을 필요로 하며, 결정 구조의 정공에 의해 제공되는 엔트로피가 증가하지 않는 한 덜 안정적인 구조를 만들 수 있습니다. 이러한 힘 사이의 최적 균형은 온도와 압력에 따라 달라지며 이는 깁스 자유 에너지 함수로 설명됩니다.
일정한 비율의 법칙은 Berthollides의 발견에서 살아남지 못했고 용액에 대한 보다 신중한 분석은 화학적 결합 또는 친화력이 화합물에만 국한되지 않는다는 것을 보여주었지만, 이는 화학자들에게 19 세기 까지 원소가 결합하여 화합물을 형성하는 방법을 연구하는 원칙적인 방법을 제공했습니다. . 베르톨리데스에 대한 이 설명은 또한 현대 화학의 규칙적인 특징인 거시적 이론과 미시적 이론 사이의 상호작용을 설명하며, 이에 대해서는 다음 섹션에서 설명합니다.
화학은 물질을 서로 다른 물질로 나누는 것과 물질이 화합물과 용액에서 함께 유지되는 과정인 화학 결합에 대한 관심으로 고전 물리학과 전통적으로 구별되었습니다. 이 섹션에서 우리는 화학자들이 모든 물질이 주기율표의 원소로 구성되어 있으며 이러한 원소가 물질의 실제 구성 요소라는 것을 어떻게 이해하게 되었는지 설명했습니다. 이러한 지식에도 불구하고 순수한 물질을 불균일 혼합물 및 용액과 구별하는 것은 매우 어려운 화학적 문제로 남아 있었습니다. 그리고 화학자들이 실체성의 기준으로서 일정한 비율의 법칙을 수용했음에도 불구하고, 베르톨리데스의 발견과 같은 화학적 복잡성으로 인해 물이 흐려졌습니다.
2. 원자론
현대 화학은 철저히 원자론적입니다. 모든 물질은 주기율표의 원소의 작은 입자 또는 원자로 구성되어 있다고 생각됩니다. 그러나 20세기 초까지 원자 와 물질의 다른 미시적 구성요소의 상태를 둘러싸고 많은 논쟁이 있었습니다. 화학 철학의 다른 많은 문제와 마찬가지로 원자론에 대한 논의는 아리스토텔레스에서 시작합니다. 아리스토텔레스는 관념의 일관성을 공격했고, 위치와 운동에 관해서만 변화할 수 있는 물질의 불가분 구성 요소라는 관념에 기초한 설명에 대해 논쟁을 벌였습니다. 본질적인 특성이 아닙니다. 우리는 19세기와 20세기 원자론의 발전뿐만 아니라 원자론에 대한 아리스토텔레스의 비판과 보일의 반응을 논의할 것입니다.
2.1 아리스토텔레스와 보일의 원자론
아리스토텔레스 시대에 원자론자들은 물질이 근본적으로 원자로 구성되어 있다고 주장했습니다. 이 원자는 나눌 수 없고 균일하며 다양한 크기와 모양을 가졌으며 위치와 운동에 대해서만 변경할 수 있지만 고유한 특성은 아닙니다. 아리스토텔레스는 이 교리를 거부하고 다음과 같은 간단한 질문으로 비판을 시작했습니다. 원자는 무엇으로 만들어졌습니까? 원자론자들은 그것들이 모두 균일한 물질로 이루어져 있다고 주장합니다. 그러나 균일한 물질 자체가 더 이상 나눌 수 없는 부분으로 분할되어야 하는 이유는 무엇입니까? 원자를 균일하지만 더 작은 부분으로 나눌 수 있는 거시적 물질과 다른 점은 무엇입니까? 그는 원자론은 이 가장 작은 크기나 원자가 가장 작은 크기인 이유를 설명하지 않고 완전히 임시적인 방식으로 최종 분할 지점으로 특정 크기를 가정한다고 주장했습니다.
일관성에 대한 질문과는 별개로, 아리스토텔레스는 원자가 특정한 성질을 가지고 있거나 결여되어 있다고 가정하는 것은 불분명하고 확실히 부당하다고 주장했습니다. 원자는 관찰 가능한 물체처럼 어느 정도의 따뜻함과 습도를 갖지 않아야 하는 이유는 무엇입니까? 그러나 만약 그렇다면, 원자가 위치와 운동만 바꾼다는 가정과 모순되게 차가운 원자의 따뜻함 정도가 따뜻한 원자의 접근에 의해 변하기 쉬워서는 안 되는 이유는 무엇입니까? 반면에 원자가 온기와 습도를 가지고 있지 않다면 거시적 물질 사이의 온습도 변화를 위치와 운동의 변화만으로 어떻게 설명할 수 있겠습니까?
이러한 고려 사항과 유사한 고려 사항으로 인해 아리스토텔레스는 원자론자들에게 실체 개념이 전혀 없었는지에 대해 의문을 제기했습니다. 세상에는 식별할 수 있는 물질이 매우 다양합니다. 동물의 살, 피, 뼈가 있습니다. 해안가의 물, 암석, 모래 및 식물성 물질 등. 원자론은 예를 들어 백색 고체 소금과 무미한 액체 물이 혼합되어 염수 또는 청동을 형성할 때 이러한 물질의 서로 다른 특성 및 상호 교환성을 수용하는 규정을 분명히 하지 않습니다. 조각상이 서서히 녹색으로 변합니다. 아리스토텔레스는 상호 상호 작용을 포함하는 결합과 접촉하게 된 신체의 주요 특징의 결과적인 수정을 포함하는 결합에 의해 오래된 물질의 파괴와 함께 새로운 물질의 생성을 수용할 필요성을 인식했습니다. 자신의 이론의 약점에도 불구하고, 그는 원자론자들에게 전혀 부족한 문제에 대한 이해를 보여줍니다. 원소의 수가 적고 다른 모든 물질이 조합에 의해 파생되고 분석에 의해 환원될 수 있는 화합물이라는 특성을 지닌 그의 개념은 화학 이론의 씨앗을 제공했습니다. 고대 원자론은 아무 것도 제공하지 않았습니다.
로버트 보일(Robert Boyle, 1627-1691)은 종종 고대와 중세 전통을 처음으로 깨고 실험적 접근과 기계 철학을 융합하여 현대 화학을 시작한 것으로 알려져 있습니다. Boyle의 화학 이론은 원소를 포함한 물질의 다양성을 모양과 크기의 변화와 현재 아원자 원자 또는 소립체라고 하는 기계적 배열의 관점에서 설명하려고 시도합니다. 보일의 유명한 실험 작업은 아리스토텔레스의 정통에 대응하려고 시도했지만 원자에 대한 그의 이론화는 그의 실험 작업에 거의 영향을 미치지 않았습니다. Chalmers(1993, 2002)는 Boyle의 원자 추측과 압력이 가스에 미치는 영향에 대한 실험 작업 사이에 아무런 관련이 없음을 기록했습니다. 이 분석은 Boyle의 화학 실험과 화학 이론화에도 동일하게 적용됩니다. 이는 주로 화학적 결합의 기계적 철학을 제공하려는 열망에 의해 주도되었습니다(Chalmers 2009, Ch. 6). Antoine Lavoisier(1743–1794)와 마찬가지로 주석가는 Boyle의 미립자 이론이 화학을 발전시키는 데 아무런 도움이 되지 않았다는 점을 분명히 했습니다. 그가 다음 세기 말에 언급했듯이 "... 만약, 용어로원소 , 우리는 물질을 구성하는 단순하고 나눌 수 없는 원자를 표현하려는 것이며, 우리가 그것에 대해 전혀 알지 못할 가능성이 매우 높습니다.”(1789, p. xxiv). 따라서 많은 주석가들은 아리스토텔레스의 화학자들에 대한 보일의 경험적 비판을 자신의 원자 이론보다 더 중요하게 여긴다.
2.2 현대 화학에서의 원자 실재론
현대 교과서는 일반적으로 John Dalton(1766-1844)의 19세기 작업 에서 화학 원자론에 대한 논의를 찾습니다 . 기계적 원자의 구조화된 배열로 원소 최소값을 감소시키려는 보일의 야망은 이때까지 포기되었고, Dalton의 이론은 단순히 각 원소가 그 원소 종류의 속성을 갖는 특징적인 크기와 질량의 가장 작은 부분을 가지고 있다고 가정합니다 . 라부아지에의 원소는 이러한 특징적인 원자의 집합체로 간주됩니다. Dalton은 이 원자 가설이 일정 비율의 법칙을 설명한다고 주장했습니다(섹션 1.5 참조).
Dalton의 이론은 화합물에 원소가 실제로 존재한다는 아이디어를 표현합니다. 그는 원자가 화학 변화에서 살아남을 수 있다고 믿었고, 이는 원소가 실제로 화합물에 존재한다는 주장을 뒷받침합니다. 그는 같은 원소의 원자는 무게가 비슷하다고 가정했습니다. Dalton은 원자가 다른 원소의 원자와 고정된 비율로 결합한다는 가정 하에, 원소가 결합할 때 무게 간에 고정된 비율로 결합하는 이유를 설명했다고 주장했습니다. 그는 또한 동일한 원소의 별개 화합물의 원소가 단순한 비율로 존재한다는 배수 비율의 법칙을 도입했습니다. 그는 이 원리가 그의 원자론으로도 설명된다고 주장했다.
Dalton의 이론은 화학계를 분열시켰고 많은 지지자들이 있었지만 상당수의 화학자들은 반원자론을 유지했습니다. 그 이유 중 일부는 Dalton의 원자 이론의 경험적 적용을 둘러싼 논쟁이었습니다. 원자는 그렇게 적은 양의 물질이므로 원자량을 어떻게 추정해야 합니까? Daltonians는 그러한 극소량을 절대적으로 측정할 수는 없지만 기준 원자와 관련하여 측정할 수 있다고 주장했습니다(자연적 선택은 수소 1임). 이것은 화합물에서 서로 다른 원자의 무게 비율을 설정하는 데 여전히 문제를 남겼습니다. Dalton은 두 원소의 화합물이 하나만 알려져 있다면 두 원소가 동일한 비율로 결합한다고 가정해야 한다고 가정했습니다. 따라서 그는 예를 들어 물을 이해했습니다. 마치 Berzelius가 도입한 공식의 관점에서 H2O로 표현되었을 것입니다(Berzelius, 1813). 그러나 이 문제에 대한 Dalton의 반응은 자의적이었습니다. 점점 더 많은 원소가 발견되고 점점 더 많은 화학 물질의 원소 조성이 정성적으로 결정됨에 따라 19세기 전반기에 보다 자연스러운 해결책을 찾는 것이 시급해졌습니다(Duhem 2002; Needham 2004; Chalmers 2005a, 2005b, 및 2008). 니덤 2004; Chalmers 2005a, 2005b 및 2008). 니덤 2004; Chalmers 2005a, 2005b 및 2008).
Dalton의 동시대인들도 다른 반대 의견을 제기했습니다. Jacob Berzelius(1779-1848)는 Daltonian 원자론은 화학 조합, 즉 원소가 어떻게 서로 결합하여 화합물을 형성하는지에 대한 설명을 제공하지 않았다고 주장했습니다(Berzelius, 1815). 그의 원자는 본질적으로 불변하기 때문에 결합이 일어나기 위해 필요한 아리스토텔레스의 생각과 같은 종류의 수정을 겪을 수 없습니다. 분자에 대한 현대적 개념과 같은 것이 부족했기 때문에 Dalton은 원자 패킹의 관점에서 화학 조합을 설명해야 했습니다. 그는 원자에 열량의 대기를 부여했는데, 이 대기의 상호 반발력은 원자가 어떻게 효율적으로 뭉쳐지는지를 설명해야 합니다. 그러나 이 생각에 설득된 사람은 거의 없었고, 나중에 Daltonian atomism으로 알려지게 된 것은 열량 껍질의 개념을 완전히 포기했습니다.
화학자들이 원소 조성이 일반적으로 물질을 구별하기에 충분하지 않다는 것을 깨달았을 때 상황은 더욱 복잡해졌습니다. Dalton은 동일한 요소가 때때로 여러 화합물을 생성한다는 것을 알고 있었습니다. 예를 들어 여러 질소 산화물이 있습니다. 그러나 일정한 비율의 법칙이 주어지면 결합 비율을 지정하여 구별할 수 있습니다. 결합 비율 은 서로 다른 질소 산화물에 대해 N 2 O, NO 및 N 2 O 3 와 같은 고유한 화학식으로 표시되는 것입니다 . 그러나 더 많은 유기 화합물을 분리하고 분석할수록 원소 조성이 물질을 고유하게 구별하지 않는다는 것이 분명해졌습니다. 동일한 원소 조성을 가진 구별되는 화합물을 이성질체 라고 합니다.. 이 용어는 1832년 Berzelius가 조성은 동일하지만 성질이 다른 유기 화합물이 처음으로 인식되었을 때 만들어졌습니다. 이성질체는 유비쿼터스이며 유기 화합물에만 국한되지 않는다는 것이 나중에 밝혀졌습니다.
이성질체는 화학적 반응성의 패턴뿐만 아니라 융점 및 끓는점과 같은 "물리적" 특성이 근본적으로 다를 수 있습니다. 이것은 디메틸 에테르와 에틸 알코올의 경우이며, 공통 구성식 C 2 H 6 O를 갖지만 (CH 3 ) 2 O 및 C 2 H 5 OH 의 두 가지 구조식 으로 표시됩니다. 이 공식 은 화학 반응성 패턴을 지배 하는 다양한 작용기 를 식별합니다. 구조식의 개념은 훨씬 더 유사한 다른 이성질체를 수용하기 위해 개발되었습니다. 이것은 입체 이성질체 의 하위 그룹의 경우였습니다. 녹는점과 끓는점과 같은 많은 물리적 특성에서 유사하고 (처음 발견되었을 때) 화학 반응성에서도 유사한 것처럼 보이는 광학 이성질체 라고 합니다. 파스퇴르 는 나트륨 암모늄염 용액을 준비하고 느린 증발로 비교적 큰 결정이 형성되도록 함으로써 타르타르산의 거울상 이성질체 (서로의 입체 이성질체)를 분리한 것으로 유명합니다. 그는 핀셋을 사용하여 결정을 두 개의 더미로 조립했는데, 하나의 부재는 다른 더미의 모양과 거울상 같은 모양을 가졌습니다. 광학 이성질체는 19 세기 초에 수정에서 처음 관찰된 현상인 면편광면을 반대 방향으로 회전시키는 특징이 있어 붙여진 이름입니다.세기. 이러한 이성질체는 그림 2에서 볼 수 있듯이 서로 거울상인 3차원 구조식으로 표시됩니다.

그림 2. 타르타르산의 거울상 이성질체. 왼쪽이 D-주석산이고 오른쪽이 L-주석산입니다. 점선 수직선은 미러 평면을 나타냅니다. 실선 쐐기는 평면에서 나오는 결합을 나타내고, 파선 쐐기는 평면 뒤로 가는 결합을 나타냅니다. 이러한 분자 구조는 서로의 거울상입니다.
이러한 발견은 종종 원자 또는 분자 가설에 의해 설명된 것으로 제시되지만, 원자론의 상태에 대한 회의론은 19세기 내내 지속되었습니다. 에른스트 마하(Ernst Mach), 게오르크 헬름(Georg Helm), 빌헬름 오스트발트(Wilhelm Ostwald), 피에르 뒤헴(Pierre Duhem)과 같은 19세기 후반 회의론자들은 원자론을 이러한 현상에 대한 적절한 설명으로 보지 않았으며 원자의 존재를 받아들일 충분한 증거가 있다고 믿지도 않았습니다. 대신에 그들은 열역학에 기초한 화학 변화의 비원자론적 이론을 옹호했습니다(Helm과 Ostwald에 대해서는 Deltete 2000에 대한 소개 참조).
원자론에 대한 Duhem의 반대는 특히 유익합니다. 일부 문헌(예: Fox 1971)에서 실증주의자로 표현되었음에도 불구하고 화학의 원자론에 대한 그의 반대는 원자의 관찰 불가능성에 호소하지 않았습니다. 대신 그는 분자가 19세기 물리학에 따르면 이론적으로 불가능하며 원자가 어떻게 서로 붙을 수 있는지에 대해서는 말할 수 없지만 합리적인 기간 동안 안정한 실체가 될 수 없는 많은 이유를 제시할 수 있다고 주장했습니다. 그는 또한 원자의 결합력을 설명하기 위해 원자에 기인한 원자가의 개념은 미시적 수준으로 투영된 거시적 특성화일 뿐이라고 주장했습니다. 그는 화학식이 원자에 의존하지 않고 해석될 수 있고 원자가의 개념이 이를 기반으로 정의될 수 있음을 보여주었습니다(Duhem 1892, 1902; 설명은 Needham 1996 참조). 원자론자들은 이 문제를 해결하는 데 실패했고 원자론자들이 거시적 기반으로 정의된 속성을 단순히 읽는 것 이상으로 원자의 특징이 무엇인지 말하지 않았다고 비판했습니다(Needham 2004). Duhem은 원자가이론 은 19세기에 개발된 소용돌이 이론(Kragh 2002)이지만 화학 현상을 설명하는 데 부적절하다고 거부했습니다.
원자론에 대한 회의론자들은 브라운 운동 에 대한 세심한 실험적 이론적 연구를 통해 20세기 초 에 마침내 확신을 갖게 되었습니다., 에멀젼에서 입자의 변동. 운동 이론의 발전과 함께 이 운동은 보이는 입자를 밀어내는 에멀젼 내의 보이지 않는 입자 때문인 것으로 의심되었습니다. 그러나 아인슈타인의 이론적 분석과 페린의 실험적 작업이 이러한 의심에 실체를 부여하고 아보가드로 수의 추정치를 제공한 것은 20세기의 첫 10년이 되어서였습니다. , 독립, 방법. 이것은 원자 가설에 여전히 회의적인 대부분의 사람들이 견해를 바꾸게 한 미시적 개체의 존재에 대한 결정적인 주장이었습니다(Einstein 1905; Perrin 1913; Nye 1972; Maiocchi 1990).
그러나 이러한 방식으로 원자의 존재를 확인하는 것은 회의론자들이 제기한 많은 질문에 대한 답이 없는 상태로 남아 있다는 점을 인식하는 것이 중요합니다. 원자가 어떻게 결합하여 분자를 형성할 수 있는지를 설명하는 원자의 본성에 대한 이론은 아직 공식화되지 않았습니다. 그리고 오늘날까지 화학 현상의 전체 범위를 설명하기에 적절한 미시적 이론이 존재하는지 여부는 여전히 미시적인 문제로 남아 있습니다. 이 문제는 우리가 감소에 대해 논의하는 섹션 6에서 추구됩니다.
3. 화학 혁명
1장에서 논의한 바와 같이, 18세기 말까지 화학 물질에 대한 현대적 개념이 Lavoisier의 작업에서 형태를 갖추기 시작했습니다. 현대적으로 보이는 원소 목록이 작성되고 있었고 또한 질량 개념이 화학에 도입되었습니다. 이러한 발전에도 불구하고 화학자들은 우리가 더 이상 받아들이지 않는 두 가지 물질인 칼로리와 플로지스톤에 대한 이론을 계속 발전시켰습니다. Lavoisier는 플로지스톤을 거부한 것으로 유명하지만 열량은 받아들였습니다. 열역학의 발전과 함께 열량 개념이 마침내 버려지기까지는 또 다른 60년이 걸릴 것입니다.
3.1 칼로리
1761년 Joseph Black은 신체를 가열한다고 해서 항상 체온이 올라가는 것은 아님을 발견했습니다. 특히 그는 0°C에서 얼음을 가열하면 같은 온도에서 액체로 변환된다는 사실을 알아냈습니다. 유사하게, 온도를 올리지 않고 끓는점에서 액체 물을 증기로 전환하기 위해 공급되어야 하는 기화 잠열이 있습니다. Black의 획기적인 발견에 대한 현대적 해석이 완전히 개발되기까지는 어느 정도 시간이 걸렸습니다. 그는 열이 신체의 온기 상태 및 그 상태의 변화와 구별되어야 함을 보여주었습니다. 그러나 열역학의 발달이 되어서야 가열은 전달된 물질과 관련 없이 따뜻해지는 성질이나 성질과 과정으로 구별되었습니다.
Black 자신은 분명히 열 현상에 대한 가설적인 설명에 참여하는 것을 경계했지만(Fox 1971), 그는 새로운 물질을 생성하기 위해 열 유체와 얼음의 조합을 포함하는 화학 반응으로 물의 융해 잠열에 대한 해석을 제안합니다. 물. Lavoisier는 Black의 잠열 개념을 열에 대한 열량 이론에 통합하여 체온을 높이지 않고 신체에 전달된 잠열을 신체와 화학적 결합으로 결합된 열량 유체로 이해하고 신체의 따뜻함이나 온도에 기여하지 않습니다. 따라서 Lavoisier의 이론은 한 물질이 다른 물질로 변형되는 것과 같은 동일한 물질의 상 변화라고 부르는 것을 이해하면서 아리스토텔레스의 이론을 유지합니다.
"열 또는 불의 요소"(Lavoisier 1789, p. 175)로 Lavoisier의 요소 목록에 있는 칼로리 수치는 "몸에 고정되어 ... [그리고] 반발력으로 작용합니다. , 또는 신체에 축적되는 정도는 고체가 유체로, 유체가 공기 형태의 탄성으로 변형되는 데 전적으로 기인합니다”(1789, p. 183). 그는 계속해서 '가스'를 "충분한 칼로리 축적에 의해 생성되는 공기와 같은 신체 상태"로 정의합니다. 수소와 함께 형성되는 이원 화합물 목록에서 열량은 수소 기체를 생성한다고 합니다(1789, p. 198). 유사하게, 인으로 형성된 이원 화합물 목록에서 칼로리는 인 가스를 생성합니다(1789, p. 204). 산소의 Lavoisian 원소 염기는 Lavoisian 원소 열량과 결합하여 복합 산소 가스를 형성합니다. 열량이 적은 산소 염기의 화합물은 산소 액체입니다(원칙적으로 Lavoisier에게만 알려짐). 따라서 우리가 액체에서 기체 산소로의 상 변화라고 부르는 것은 그에게 물질의 변화입니다. 빛은 또한 그의 원소 목록에 포함되어 있으며 "산소와 친화력이 크며 ... 열량과 함께 가스 상태로 바꾸는 데 기여합니다"(1789, p. 185).
3.2 플로지스톤
거의 같은 시기의 또 다른 물질 개념은 플로지스톤으로, 이는 18세기 산화와 환원이라고 불리는 과정 이론의 기초가 되었습니다. 게오르크 에른스트 스탈(Georg Ernst Stahl, 1660–1734)은 더 오래된 이론적 아이디어를 바탕으로 이론을 도입했습니다. 연금술사들은 금속이 소성되면 수은 원리를 잃는다고 생각했고 물질이 가열에 의해 슬래그, 녹 또는 재로 바뀌면 황 원리를 잃는다고 생각했습니다. Johann Joackim Becher(1635-82)는 17세기 말에 이러한 아이디어를 수정하여 금속의 하소는 그가 가연성의 원리라고 부른 것의 손실을 수반하는 일종의 연소라고 주장했습니다. 이후 Stahl은 이 원리를 '플로지스톤'으로 이름을 변경하고 이론을 더욱 수정하여 플로지스톤이 화학 반응에서 한 물질에서 다른 물질로 이동할 수 있다고 주장했습니다.
예를 들어, 금속은 금속의 calx와 플로지스톤의 화합물로 생각되었고, 유황은 황산과 플로지스톤의 화합물로 생각되었으며, 인은 인산과 플로지스톤의 화합물로 생각되었습니다. 연소 후 재가 거의 또는 전혀 남지 않는 탄소와 같은 물질은 플로지스톤이 풍부한 것으로 간주되었습니다. 목탄의 도움으로 종아리에서 금속을 준비하는 것은 탄소에서 금속으로 플로지스톤이 이동하는 것으로 이해되었습니다.
탄소를 플로지스톤의 원천으로 간주하고 더 이상 단순히 따뜻함의 원천이 아닌 것은 화학 반응을 이해하는 데 한 걸음 더 나아간 것입니다(Ladyman 2011은 플로지스톤 화학에 대한 구조적 사실주의적 해석을 뒷받침하기 위해 강조함). 플로지스톤 이론은 반응이 물질의 한 부분을 다른 부분으로 대체하는 것을 포함할 수 있다고 제안했는데, 이전에는 모든 반응이 단순한 결합 또는 해리로 생각되었습니다.
플로지스톤 이론은 Henry Cavendish(1731-1810)와 Joseph Priestley(1733-1804)에 의해 더욱 발전되었으며, 이들은 둘 다 플로지스톤 자체의 특성을 더 잘 특성화하려고 시도했습니다. 1760년 이후, 플로지스톤은 일반적으로 '가연성 공기'(수소)라고 불리는 것으로 확인되었으며, 금속을 무리아산(염산)과 반응시켜 성공적으로 포획했습니다. 이러한 "공기"의 생성 및 특성화에 대한 추가 실험 작업에서 Cavendish와 Priestley는 현재 우리가 산소라고 부르는 것을 '플로지스톤 제거된 공기'로, 질소를 '플로지스톤 포화 공기'로 식별했습니다.
반응물과 생성물의 무게를 일상적으로 측정하게 되면서 금속이 calx가 되면 무게가 증가한다는 것이 분명해졌습니다. 그러나 플로지스톤 이론에 따르면 calx는 플로지스톤의 손실을 수반합니다. 물질의 손실을 수반하는 과정이 체중 증가를 수반할 수 있다는 생각이 우리에게는 이상해 보이지만 플로지스톤 이론가들은 즉시 걱정하지 않았습니다. 일부 플로지스톤 이론가들은 플로지스톤의 '부상' 특성에 근거한 설명을 제안했는데, 이는 나중에 Priestly가 플로지스톤의 '음의 무게'라고 불렀습니다. 이 현상에 대한 또 다른 설명은 거의 무중력의 플로지스톤이 종아리의 모공에서 무겁고 응축된 공기를 몰아냈다는 것입니다. 최종 결과는 더 가벼운 제품이었습니다. 질량의 개념은 아직 화학에서 중심적인 역할을 하지 않았기 때문에 이러한 설명은 상당히 합리적이라고 생각되었습니다.
그러나 1770년대 말까지 Torbern Olaf Bergman(1735-1784)은 금속과 그 calxes의 무게를 주의 깊게 측정했습니다. 그는 금속의 하소가 주변 공기에 의해 손실된 산소의 무게와 동일한 무게의 증가를 초래한다는 것을 보여주었습니다. 이것은 위에서 주어진 두 가지 설명을 배제했지만 흥미롭게도 그는 금속이 calx로 변형되면서 무중력 플로지스톤이 손실된다고 주장하면서 이것을 자신의 보폭으로 받아들였습니다. 이 플로지스톤은 공기의 산소와 결합하여 상당한 따뜻함을 형성하고, 이는 차례로 플로지스톤이 손실된 후 남아 있는 금속과 결합하여 캘스를 형성합니다. Lavoisier는 이 계획에서 플로지스톤을 제거하여 이 설명을 단순화했습니다. 이 순간은 많은 사람들이 화학 혁명이라고 부르는 것입니다.
4. 화학의 구조
현대 화학은 주로 원소 조성이 아닌 미세 구조를 다룹니다. 이 섹션에서는 구조에 중점을 둔 화학의 역사와 결과를 살펴봅니다. 이 섹션의 전반부는 화학이 원소 구성과 관련된 과학에서 구조와 관련된 과학으로의 전환을 설명합니다. 후반부는 결합과 분자 구조에 대한 현대적 설명에 의해 제기된 개념적 퍼즐에 초점을 맞출 것입니다.
4.1 구조식
18 일과 19일 초 에수세기 동안 물질의 화학적 분석은 물질을 원소 성분으로 분해하는 것으로 구성되었습니다. 일정한 비율의 법칙의 적용과 결합된 신중한 무게 측정을 통해 화학자는 구성 요소의 질량 비율로 물질을 특성화할 수 있었습니다. 이는 화학자가 화합물의 조성을 의미하는 것입니다. 이 기간 동안 Berzelius는 문자가 요소를 나타내고 아래 첨자가 다른 물질의 비교를 용이하게 하는 척도의 비율을 나타내는 이러한 질량비에 대한 구성 공식 표기법을 개발했습니다. 이 비율은 그램 단위의 중량 비율을 반영하지만 간단한 숫자는 중량 비율을 화학 당량으로 다시 표현한 결과입니다. 예를 들어, 수식 'H 2 O' 및 'H2 S'는 황화수소에 수소와 결합된 황이 있는 만큼 물에 수소와 결합된 산소가 많다고 말합니다. 그러나 무게로 측정하면 'H 2 O'는 8g의 산소에 1g의 수소를 결합한 비율에 해당하고 'H 2 S'는 16g의 황에 1개의 수소를 무게로 합친 것에 해당합니다.
19 세기 의 첫 10년까지 , 유기 화학의 초기 하위 분야는 점점 더 많은 수의 화합물을 식별하고 합성하기 시작했습니다(Klein 2003). 2.2절에서 지적한 바와 같이 이 시기에 이성질체 현상이 인지되고 구조식이 도입되어 거시적 성질이 다른 동일한 조성식의 물질을 구별하게 되었다. 일부 화학자들은 구조식이 거시적으로 이해될 수 있다고 생각했지만, 다른 화학자들은 그것을 분자라고 하는 미시적 실체의 표현으로 해석하려고 했습니다.
19세기 전반부에는 이성질체를 이해하는 데 분자 구조의 개념이 어떻게 배치될 수 있는지에 대한 일반적인 합의가 없었습니다. 그러나 세기 후반기에 아우구스트 케쿨레(August Kekulé, 1829-1896)의 구조 이론을 중심으로 합의가 이루어졌습니다. Kekulé는 탄소가 1가 원소와 1:4 비율로 결합하는 경향이 있다고 언급했습니다. 그는 이것이 각 탄소 원자가 4개의 다른 원자, 심지어 다른 탄소 원자와 결합을 형성할 수 있기 때문이라고 주장했습니다(1858 [1963], 127). 이후의 논문에서 Kekulé는 탄소 원자 사이의 이중 결합 개념을 도입하여 탄소의 4가에 대한 명백한 예외를 처리했습니다. 그는 방향족 화합물로 치료를 확장하여 벤젠의 유명한 육각형 구조를 생성했습니다(Rocke 2010 참조).
원자 사이의 결합에 대한 Kekulé의 아이디어는 이성질체를 이해하기 위한 중요한 단계였습니다. 그러나 구조 이론에 대한 그의 발표는 도식적 표현의 명확한 시스템이 부족하여 대부분의 현대 구조 표현 시스템은 유기산 중 이성질체에 관한 Alexander Crum Brown(1838-1932)의 논문(1864 [1865])에서 시작되었습니다. 여기에서 구조는 원자 사이의 연결로 표시되었습니다(그림 3 참조).
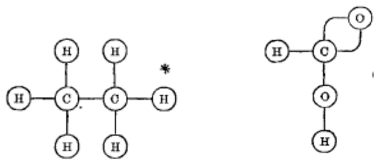
그림 3. Crum Brown의 그래픽 표기법에서 에탄과 포름산의 묘사. (1864 [1865], 232)
Edward Frankland(1825-1899)는 화학 학생을 위한 강의 노트 (Russell 1971; Ritter 2001)의 연속 판에서 Crum Brown의 표기법을 단순화하고 대중화했습니다. Frankland는 또한 원자 사이의 연결에 대한 '결합'이라는 용어를 최초로 도입했습니다(Ramberg 2003).
구조 이론 개발의 다음 단계는 James Dewar(1842–1943)와 August Hofmann(1818–1892)이 Crum Brown의 공식(Meinel 2004)과 밀접하게 일치하는 물리적 모델을 개발했을 때 이루어졌습니다. 듀어의 분자는 한 쌍의 구리 밴드 중앙에 위치한 검은색 원반으로 대표되는 탄소 원자로 구성되었습니다. Hofmann의 모델에서 원자는 결합으로 연결된 당구공(탄소는 검정색, 수소는 흰색, 산소는 빨간색)으로 표시되었습니다. 고로케 볼과 연결 암의 구체적인 3차원 구조로 구현되었지만, 이러한 모델의 3차원성은 인공적이었다. 매체 자체는 원자의 표현을 공간에 퍼뜨리도록 강요했습니다. 그러나 이것이 화학적 현실에 해당합니까?
Kekulé, Crum Brown 및 Frankland는 이 질문에 답할 때 매우 신중했습니다. Kekulé는 화학적 성질로부터 추론할 수 있는 겉보기 원자 배열, 즉 그가 "화학 구조"라고 불렀던 원자 배열과 원자의 실제 공간 배열을 구별했습니다(Rocke 1984, 2010). Crum Brown은 그의 그래픽 공식에서 "물리적 의미가 아니라 단지 원자의 화학적 위치를 나타내는 것"이라고 경고하면서 비슷한 구분을 했습니다(Crum Brown, 1864, 232). Frankland는 "이 그래픽 공식은 분자의 모양이나 구성 원자의 상대적 위치를 나타내기 위한 것이 아님을 주의 깊게 염두에 두어야 합니다"(Biggs et al. 1976, 59).
이러한 주석을 해석하는 한 가지 방법은 일종의 반실재론을 반영한다는 것입니다. 구조식은 화합물의 화학적 거동을 요약하기 위한 이론적 도구일 뿐입니다. 또는 거의 말할 수 없는 미시적 영역에 대한 명확한 약속을 피하면서 단순히 불가지론자일 수도 있습니다. 그러나 다른 의견은 현실주의적 해석을 제안하지만 구조 공식 이 공간 배열 의 위상 구조 만을 나타내는 해석이 있습니다.
화합물의 다른 원자를 연결하고 다른 방향으로 동등하게 그려질 수 있는 선은 동일한 원소를 함께 연결하는 경우에만 결합의 명확한 배치를 나타내는 역할을 합니다. 따라서 질산의 공식은 다음을 나타냅니다. 산소의 3개 구성 원자 중 2개는 질소와만 결합되고, 세 번째 산소 원자는 질소 및 수소와 결합됩니다(Frankland, Biggs et al. 1976, 59 인용, Hendry 2010b 참조).
완전한 공간적 해석을 향한 움직임은 1874년 Jacobus van 't Hoff(1852-1911)와 Joseph Achille Le Bel(1847-1930)이 탄소의 4개 결합의 방향에 대한 사면체 구조를 동시에 가정함으로써 진행되었습니다. 광학 이성질체(그림 4 및 섹션 2.2 참조). 탄소 원자가 4가지 다른 구성 요소에 결합되어 있으면 왼손과 오른손이 할 수 없는 것처럼 거울 이미지에 겹쳐질 수 없습니다. 이것은 키랄 분자의 두 가지 가능한 구성을 발생시켜 평면 편광을 다른 방향으로 회전시키는 능력을 제외하고는 물리적 및 화학적 특성이 동일한 별개의 물질을 구별합니다.
van 'Hoff와 Le Bel은 키랄 분자가 평면 편광의 회전에 영향을 미치는 메커니즘에 대한 설명을 제공하지 않았습니다(Needham 2004). 그러나 세기말까지 공간구조는 Viktor Meyer(1848–1897)의 입체장애 개념과 Adolf von Baeyer(1835–1917)의 개념과 함께 유기화합물의 반응성과 안정성 측면을 설명하는 데 사용되었습니다. 내부 분자 변형(Ramberg 2003).
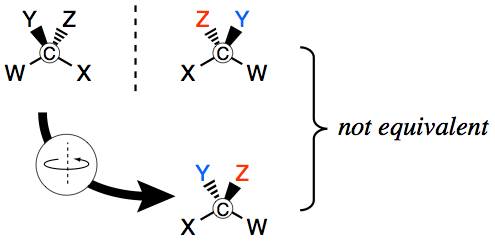
그림 4. 탄소 원자 주위의 치환기의 사면체 배열의 개략도. 치환기 Y와 Z의 위치를 비교하십시오.
이러한 이론이 본질적으로 공간적이라는 점을 감안할 때 화학 조합과 원자가에 대한 전통적인 질문은 새로운 방향을 제시했습니다. 특정 공간 배열에서 원자를 함께 묶는 것은 무엇입니까? 물론 답은 화학 결합 입니다.
4.2 화학 결합
19 세기 말에 구조 이론이 널리 받아들여지면서 화학자들은 원자를 서로 연결하고 이들 원자 사이의 공간적 관계를 제한하는 요소에 관심을 집중하기 시작했습니다. 즉, 그들은 화학 결합을 조사하기 시작했습니다. 화학적 결합에 대한 현대의 이론적 설명은 양자역학적이지만, 심지어 현대의 결합 개념도 20세기 초에 GN 루이스가 개발한 고전적 결합 개념에 큰 영향을 받았습니다 .
고전적인 화학 결합
GN Lewis(1875-1946)는 화학 결합에 대한 최초의 영향력 있는 이론을 담당했습니다(Lewis 1923; 배경은 Kohler 1971, 1975 참조). 그의 이론에 따르면 화학 결합은 원자 사이에서 공유되는 전자 쌍입니다. 루이스는 또한 현대 화학에서 현저하게 회복력이 있는 것으로 판명된 이온 화합물 과 공유 화합물 을 구별 했습니다.
이온 화합물은 일반적으로 중성 결정 격자에 배열된 전하를 띤 이온으로 구성됩니다. 중성은 양으로 하전된 이온(양이온)이 음으로 하전된 이온(음이온)의 균형을 맞추기 위해 정확히 정확한 수일 때 달성됩니다. 예를 들어, 일반적인 염의 결정 은 염소 음이온(Cl - )만큼 많은 나트륨 양이온(Na + )을 포함 합니다. 분리된 원자에 비해 나트륨 양이온은 전자를 잃고 염소 음이온은 전자를 얻습니다.
반면에 공유 화합물은 개별 분자이거나 무한히 반복되는 구조입니다. 두 경우 모두, 루이스는 그것들이 공유된 전자 쌍에 의해 함께 결합된 원자로부터 형성된다고 생각했습니다. 수소 가스는 단일 공유 결합으로 결합된 두 개의 수소 원자로 구성된 분자로 구성되어 있다고 합니다. 두 개의 산소 원자와 이중 결합으로 구성된 분자의 산소 가스; 4개의 등가 탄소-수소 단일 결합으로 구성된 분자로 구성된 메탄과 공유 결합된 SiO 2 단위 배열이 무한히 반복되는 이산화규소(모래) 결정입니다 .
분자 구조에 대한 루이스의 설명에서 중요한 부분은 결합의 방향성에 관한 것입니다. 이온성 화합물에서 결합은 정전기적이므로 방사상 대칭입니다. 따라서 개별 이온은 이웃 중 어느 것과도 특별한 관계가 없습니다. 반면에 공유 결합이나 비극성 결합에서는 결합의 방향이 정해져 있습니다. 그들은 원자 중심 사이에 있습니다.
공유 결합의 본질은 최근의 화학 문헌 철학에서 상당한 논의의 주제가 되어 왔습니다(Berson 2008; Hendry 2008; Weisberg 2008). 화학 결합은 화학적 예측, 개입 및 설명에서 중심적인 역할을 하지만 정확하게 정의하기 어려운 개념입니다. 화학 결합에 대한 고전적 개념과 양자 역학 개념 사이, 심지어 서로 다른 양자 역학 모델 간에도 근본적인 불일치가 존재합니다. 입문 교과서를 넘어 고급 치료로 넘어가면 결합에 대한 많은 이론적 접근 방식을 찾을 수 있지만 결합 자체에 대한 정의나 직접적인 특성화는 거의 없습니다. 일부는 이러한 정의의 명확성 부족을 모든 화학자들이 공유하는 공통 배경 지식의 탓으로 돌릴 수 있지만,
4.3 결합의 구조적 개념과 그 도전
화학 결합에 대한 새로운 철학 문헌은 화학 결합의 구조적 개념으로 시작됩니다 (Hendry 2008). 구조적 개념에서 화학 결합은 개별 원자 중심 사이에 국한되어 분자를 함께 유지하는 역할을 하는 분자 이하의 물질적 부분입니다. 이것은 19세기 말에 생겨난 화학 결합의 개념으로, 합성 및 분석 화학의 관행을 계속해서 알려줍니다. 그러나 결합의 구조적 개념이 올바른가요? 철학 문헌에서 몇 가지 뚜렷한 도전이 제기되었습니다.
첫 번째 문제는 양자 역학의 온톨로지와 화학 결합의 겉보기 온톨로지 사이의 비호환성에서 비롯됩니다. 전자는 원칙적으로 구별할 수 없으므로( 양자 이론의 동일성과 개별성 ) 결합에 대한 양자 역학적 설명은 특정 전자의 동일성에 의존할 수 없습니다. 결합의 구조적 개념을 루이스와 같은 방식으로 해석하면 결합이 특정 원자가 제공한 특정 전자 쌍으로 구성되어 이 그림이 양자 역학과 양립할 수 없음을 알 수 있습니다. 관련된 반대 의견은 실험적 및 이론적 증거 모두에서 전자가 비편재화 되어 있음을 시사한다고 지적합니다., 전체 분자에 "번짐". 양자 역학은 전자 쌍이 결합된 원자 사이에 국한될 것으로 기대하지 말라고 말합니다. 또한 Mulliken은 공유 결합 형성에 쌍이 필요하지 않다고 주장했습니다. 수소 분자의 전자는 “둘 각각의 수소 핵이 하나만 있을 때보다 두 개의 수소 핵이 있을 때 더 단단히 결합됩니다. 두 개의 전자가 짝을 이룬다는 사실은 … 대체로 부수적인 것 같습니다.”(1931, p. 360). 후기 저자들은 이 논쟁을 뒷받침 하는 H 2 + 이온의 안정성을 지적합니다.
결합의 구조적 개념을 옹호하는 사람들은 GN Lewis의 특정한 구조적 설명이 유일하게 가능한 것이 아니라는 점을 지적함으로써 이러한 도전에 대응합니다. 구조적 개념의 결합은 분자 이하이어야 하고 방향성이 있어야 하지만 전자쌍일 필요는 없습니다. 양자 존재론의 도전에 구체적으로 대응하여 그들은 결합이 전자가 아니라 연결하는 원자 중심에 의해 개별화되어야 한다고 주장합니다. 전자가 물리적으로 결합에 참여하는 한 개별적으로 참여하지 않습니다. 모든 전자는 전체 분자와 연관되어 있지만 전자 밀도의 일부는 국소화될 수 있습니다. 탈편재화에 대한 반대에 대해 그들은 모든 구조적 설명이 요구하는 것은 일부분자의 전체 전자 밀도의 일부는 결합과 관련된 기능을 담당하며 루이스 모델(Hendry 2008, 2010b)에서와 같이 원자 사이에 직접 국한되어 있다는 가정이 필요하지 않습니다.
결합의 구조적 개념에 대한 두 번째 도전은 화학 현상에 대한 예측을 하기 위해 양자 역학을 적용하는 컴퓨터 화학에서 비롯됩니다. 양자 화학자 Charles Coulson(1910-1974)의 연구를 바탕으로 Weisberg(2008)는 화학 결합의 구조적 개념이 양자 화학에서 견고하지 않다고 주장했습니다. 이 주장은 분자 구조의 양자 역학 모델의 역사를 살펴봅니다. 초기 양자 역학 모델에서는 결합의 구조적 개념과 매우 유사한 것이 보존되었습니다. 전자 밀도는 대부분 원자 중심 사이에 국한되어 있으며 분자를 함께 유지하는 역할을 합니다. 그러나 이러한 초기 모델은 실험과 질적으로만 일치하는 결합 에너지 및 결합 길이에 대한 경험적 예측을 했습니다.
분자 구조의 후속 모델은 전자 밀도가 원자 사이의 영역을 떠나 분자 전체에서 비편재화되도록 "허용"되었을 때 실험과 훨씬 더 잘 일치했습니다. 모델이 더욱 개선됨에 따라 결합은 하위 분자 현상이 아닌 전체 분자 현상으로 보이게 되었습니다. Weisberg는 그러한 고려가 결합의 구조적 개념을 거부하고 그것을 분자 전반의 개념으로 대체하도록 이끌어야 한다고 주장합니다. 한 가지 가능성은 결합이 분자의 에너지 안정화라고 말하는 결합 의 에너지 개념입니다. 엄밀히 말하면 이 견해에 따르면 화학 결합은 존재하지 않습니다. 본딩은 실재하지만 본드는 그렇지 않습니다(Weisberg 2008; Coulson 1952, 1960 참조).
결합의 구조적 관점에 대한 도전은 철학 및 화학 문헌에서 여러 반응을 불러일으켰습니다. 화학 실습에 대한 첫 번째 호소: 합성 및 분석 활동에 참여하는 화학자는 결합의 구조적 개념에 의존합니다. 100,000,000가지가 훨씬 넘는 화합물이 발견되거나 합성되었으며 모두 공식적으로 특성화되었습니다. 결합의 구조적 개념과 같은 중심 화학 개념이 자연에서 실제적인 것을 선택하지 않는다면 이러한 성공을 어떻게 설명할 수 있겠습니까? 평생 동안 Linus Pauling(1901-1994)은 이 견해를 옹호했습니다.
매우 약한 결합 분자의 중요성에 대해 논의한 Berson(2008)의 또 다른 반대 의견이 있습니다. 예를 들어, 2-methylenecyclopentane-1,3-diyl의 4가지 구조 이성질체가 있습니다. 가장 안정적인 구조는 전자 스핀이 평행한 상태인 비정상적으로 안정적인 단일항 상태로 인해 정상적인 결합 상호작용에 해당하지 않습니다. Berson은 이것이 "결합의 형성이 실제로 불안정한 분자를 생성하는" 경우라고 제안합니다. 즉, 결합과 분자 전체의 안정화가 떨어져서 에너지 개념이 무너집니다.
마지막으로 "Atoms in Molecules" 프로그램(Bader 1991; 설명은 Gillespie and Popelier 2001, Chs. 6 & 7 참조)은 기능적으로 이해된 결합의 구조적 개념을 고수할 수 있지만 전자가 이 관계를 실현하는 방법. 예를 들어, Bader는 분자 전체의 전자 밀도의 위상적 특징의 관점에서 '결합 경로'를 정의할 수 있다고 주장합니다. 이러한 결합 경로는 물리적 위치를 가지며 일반적으로 고전적인 공유 결합과 밀접하게 일치합니다. 더욱이 그들은 결합이 원자 사이의 전자 밀도의 증가를 수반한다는 아이디어를 부분적으로 입증합니다. 결합 경로는 최대 전자 밀도의 축입니다(결합 경로를 수직 방향으로 두면 전자 밀도의 감소가 수반됨). 또한 이 접근 방식에는 많은 기술적 이점이 있습니다. 분자 차원의 전자 밀도는 양자 역학의 온톨로지 내에 존재하므로 어떤 양자 역학 모델도 이를 배제할 수 없습니다. 또한, 전자 밀도는 다른 양자 역학적 특성보다 계산이 훨씬 쉽고 X선 회절 기술을 사용하여 경험적으로 측정할 수 있습니다.

그림 5. 채권이 너무 많습니까? C 60 의 각 탄소 원자에서 내부의 갇힌 Ar 원자까지의 60개 결합 경로.
불행히도, Bader의 접근 방식은 채권의 구조적 개념을 위해 반드시 하루를 절약하지는 않습니다. 그의 비평가들은 그의 설명이 극도로 관대하고 화학적으로 의심되는 위치에 결합 경로를 설정한다고 지적합니다. 예를 들어, 그의 설명에 따르면 축구공 모양의 벅민스터 풀러렌 분자(C 60 )를 가지고 그 안에 아르곤 원자를 가두었을 때 그림 5(Cerpa et al. 2008). 화학 조합의 가장 기본적인 원리 중 하나는 아르곤이 거의 결합을 형성하지 않는다는 사실이기 때문에 대부분의 화학자들은 이것이 불가능하다고 생각할 것입니다(반응은 Bader 2009 참조).
비편재화된 계정에 대해 일반적으로 인정되는 문제는 화학자들이 이전 가능성이라고 부르는 것이 부족하다는 것입니다. 구조적 관점의 핵심은 우리가 보았듯이 다른 물질에 공통적인 작용기의 발생입니다. 예를 들어, 알코올은 히드록실 OH 기를 공통으로 갖는 것이 특징입니다. 이것은 3600cm –1 에서 강한 적외선 흡수 가 OH 그룹의 신호로 간주된다는 점에서 반영됩니다. 그러나 ab initio QM 처리는 다른 수의 전자에 의해 제기된 다른 문제를 보고 한 분자에서 다른 분자로 이동할 수 있는 OH 그룹과 같은 분자 구조의 일부가 있다는 것을 반영하지 못합니다. 공통(Woody 2000, 2012).
또 다른 문제는 화학적 결합의 원인에 대한 자세한 이해입니다. 수년 동안 Hellman-Feynman 정리에 기반한 지배적인 견해는 이것이 본질적으로 양의 핵과 음의 전자 구름 사이의 정전기적 인력이라는 것이었습니다(Feynman 1939). 그러나 원래 Hellman이 제안하고 Rüdenberg가 개발한 대안이 최근에 눈에 띄게 되었습니다. 이것은 운동 에너지의 양자 역학적 유사성을 강조합니다(Needham 2014). 현대의 설명은 여러 가지 미묘한 양자 역학적 특징에 의존할 수 있습니다. 그러나 이러한 세부 사항이 화학 반응에 의한 안정한 화합물의 형성을 지배하는 열역학적 원리를 모호하게 해서는 안 됩니다. 앳킨스가 말했듯이,
… 관련된 물질이 더 낮은 에너지로 떨어졌지만 이것이 반응이 일어나는 이유는 아닙니다. 전체적으로 우주의 에너지는 일정하게 유지됩니다. … 일어난 모든 일은 초기에 국부적인 에너지가 분산되었다는 것입니다. 그것이 화학 변화의 원인입니다. 물리학과 마찬가지로 화학에서도 자연 변화의 원동력은 혼란스럽고 목적도 없고 방향도 없는 에너지 분산입니다. (Atkins 1994, p. 112)
이것과 다른 모든 결합 모델이 직면한 어려움으로 인해 많은 화학자와 철학자가 다원주의를 주장하게 되었습니다. 양자 화학자 로알드 호프만(Roald Hoffmann)은 "결합은 어떤 기준에 따라 결합이 될 것이고 다른 기준에 따라 결합이 될 것입니다 ... 개념에 재미를 느끼고 우리에게 과장된 광고를 피하십시오"(Hoffmann 2009, 기타 인터넷 리소스).
4.4 분자 구조와 분자 모양
분자 구조와 기하학에 관한 대부분의 철학적 문헌은 결합에 관한 것이지만 분자 구조 자체의 개념에 관한 많은 중요한 질문이 있습니다. 첫 번째 문제는 분자 구조의 올바른 정의와 관련이 있습니다. 교과서는 일반적으로 분자의 구조를 원자의 평형 위치로 설명합니다. 따라서 물의 구조는 수소 원자와 산소 원자 사이의 각도가 104.5º라는 특징이 있습니다. 그러나 이것은 분자가 고정된 실체가 아니기 때문에 문제가 되는 개념입니다. 원자는 우리가 구부리고, 비틀고, 흔들고, 가위질하는 것과 같이 묘사할 수 있는 방식으로 끊임없이 움직이고 있습니다. 따라서 Bader는 분자 구조를 결합 경로의 토폴로지 또는 연속 변환에 의해 보존되는 원자 간의 관계로 생각해야 한다고 주장합니다(Bader 1991).
분자 구조에 관한 두 번째 문제는 훨씬 더 근본적인 것입니다. 분자는 구조식이 나타내는 종류의 모양과 방향성 특징을 가지고 있습니까? 지금까지 논의한 역사를 감안할 때 대답은 분명히 예인 것 같습니다. 실제로, x-선 결정학, 분광학 및 제품 분석을 포함한 여러 간접 실험 기술은 모양의 존재뿐만 아니라 특정 분자 종의 특정 모양에 대한 수렴 증거를 제공합니다.
그럼에도 불구하고, 양자 역학은 분자 모양의 개념에 도전을 제기합니다. 분자종의 양자역학적 처리에서는 손으로 넣지 않으면 모양이 생기지 않는 것 같다. (Woolley 1978; Primas 1981; Sutcliffe & Woolley 2012).
친숙한 화학 구조 이론과 분자에 대한 양자역학적 설명 사이의 이러한 긴장은 여러 가지 방법으로 해결될 수 있습니다. 분자 구조에 대한 제거론을 수용할 수도 있습니다. 양자 역학은 보다 근본적인 이론이며 그 존재론은 분자 구조를 위한 자리가 없습니다. 따라서 분자 구조는 존재하지 않습니다. 우리가 알고 있는 철학자나 화학자는 이 옵션을 지지하지 않았습니다. 또 다른 가능한 응답은 기본 물리학에 다른 호소력을 제공합니다. 무언가가 파동함수 대칭을 깨고 원자의 분자 위치를 지정해야 합니다. 이것은 다른 분자와의 상호 작용 또는 측정 장치와의 상호 작용일 수 있습니다. 따라서 분자 모양은 부분적으로 상호 작용에 의해 구성되며 고유 속성이 아니라 관계 속성입니다(Ramsey 1997).
관련 옵션은 일종의 실용주의입니다. Hans Primas는 엄밀히 말해서 분자에 대한 양자역학적 기술은 전체 우주 기술이어야 한다고 주장합니다. 우리가 어떤 표적 분자 시스템 주위에 관심의 경계를 어떻게 그렸든, 실제로 시스템은 열려 있고 우주의 다른 모든 것과 상호 작용합니다. 따라서 특정 분자의 모양은 우주의 다른 모든 것과 상호 작용한 결과일 수 있습니다. 우리는 시스템을 닫힌 시스템으로 취급할 때 모양이 없는 분자의 역설만 얻습니다. 실용적인 목적을 위해 개방형 시스템을 폐쇄형으로 취급하는 것은 좋지만 이것이 이상화라는 것을 항상 이해해야 합니다. 우리는 개방형 시스템이 닫히는 것과 같은 이상화를 실제처럼 취급해서는 안 됩니다.
따라서 분자의 구조적 표현이 편재함에도 불구하고 분자 모양의 개념조차 모호하지 않다는 것이 밝혀졌습니다. 많은 양자 역학 모델에서 이상화를 가리키는 Primas의 접근 방식은 많은 화학자들에게 받아들여지고 있습니다. 그러나 분자 모양을 이해하는 방법에 대한 철학 문헌의 일치와 같은 것은 없습니다.
4.5 Microessentialism: 물은 H 2 O인가?
구조에 대한 이 섹션의 마지막 부분에서 우리는 철학자들이 가장 좋아하는 예인 "물은 H 2 O 이다"라는 명제를 고려합니다. 이 테제는 종종 논쟁의 여지가 없는 사실로 간주되며 의미론적 외부주의와 자연 종류에 대한 본질주의의 증거로 사용됩니다(Kripke 1980; Putnam 1975, 1990). 참조이론과 의미외부론에 대한 일반논제는 이 글의 범위를 벗어나므로 우리는 좁게 화학적 본질론에 초점을 맞춘다. 공통의 필수 미세구조를 갖는 것이 화학 종류를 개별화하고 일반적인 특징을 설명하기에 충분합니까? 그렇다면 "H 2 O인 것"이 물을 개별화하기에 충분합니까?
본질주의적 논제는 종종 "물 = H 2 O" 또는 "(모든 그리고 유일한) 물은 H 2 O다" 로 양식화됩니다 . 동일성이 의미가 있는지(Needham 2000) 그리고 술어가 두 번째 공식에 적용되는지 이해하는 문제(Needham 2010a)를 무시하면 두 공식이 본질주의자들이 의도하는 종류의 테제를 표현하는지 명확하지 않습니다. "H 2 O"는 어떤 미세구조에 대한 설명이 아닙니다. 오히려 "H 2 O"는 물을 만들기 위해 수소와 산소의 결합 비율을 설명하는 조성 공식입니다.
표준 공식의 합리적인 표현은 "물은 H 2 O 분자의 집합체입니다."입니다. 그러나 "H 2 O 분자"라는 표현이 특정 미세 개체를 설명하지만, 물에서 미세 입자의 종류를 소진시키는 것은 결코 아니며 물에서 관련되어 있는 미세 구조 에 대해서는 아무 것도 말하지 않습니다 . 물의 미세 구조를 완전히 설명하려면 이 상호 연결된 구조의 세부 사항을 자세히 설명하고 온도와 압력에 따라 어떻게 달라지는지, 시간이 지남에 따라 어떻게 변하는지 자세히 설명해야 합니다(Finney 2004).
다른 많은 물질과 마찬가지로 물도 단순히 개별 분자의 집합체로 설명할 수 없습니다. 다음은 미세 구조의 복잡성에 대한 몇 가지 예입니다. 물은 자가 이온화됩니다. 즉, 수소 및 수산화물 이온이 액체 물에서 H 2 O 분자 와 공존하고 계속해서 재결합하여 H 2 O 분자를 형성합니다. 동시에 H2O 분자는 더 큰 고분자 종으로 결합합니다. 이러한 복잡성을 언급하는 것은 단지 현학적인 것이 아닙니다. 왜냐하면 그것들은 종종 물질의 가장 두드러진 특성을 야기하기 때문입니다. 예를 들어, 물의 전기 전도도는 양전하(수소 이온)가 고분자 클러스터의 한 지점에 부착되어 클러스터를 가로질러 전하의 조정된 이동을 유도하여 먼 곳에서 수소 이온을 방출하는 메커니즘 때문입니다. 가리키다. 그 효과는 그것을 운반하기 위한 물질의 이동 없이 전하가 한 지점에서 다른 지점으로 이동된다는 것입니다. 클러스터 형성의 기초가 되는 수소 결합은 또한 높은 녹는점과 끓는점, 녹을 때 밀도의 증가를 포함하여 물의 다른 많은 독특한 특성의 근원입니다. van Brakel이 주장했듯이(1986, 2000),
어쩌면 물은 단순히 H 2 의 집합이 아닐 수도 있습니다.O 분자, 그러나 그것은 확실히 미세 구조를 가지고 있으며 아마도 본질적인 이론은 "물은 미세 구조를 가진 모든 것입니다"라는 라인을 따라 다시 작성될 수 있습니다. 그러나 이 논문은 여전히 “물”이 Putnam이 고정관념적 특징이라고 부르는 것을 특징으로 하는 술어라는 생각을 지지합니다. 이것은 미시구조의 대부분이 실제로 유추되는 비점, 비열, 잠열 등과 같은 거시적이지만 과학적으로 중요한 특성의 중요성을 무시합니다. 실제로 화학자들이 물질의 동일성과 순도를 결정하기 위해 사용하는 많은 기준은 미시적인 것이 아니라 거시적인 것입니다. 사실로,
그렇다면 물은 H2O 인가? 결국 이 질문에 대한 답은 이 문장을 어떻게 해석하느냐에 달려 있습니다. 많은 화학자들이 물이 H 2 O 가 아니라는 사실을 알게 되면 놀랄 것입니다 . 그러나 아마도 이것은 "H 2 O"를 속기(Weisberg 2005)로 읽거나 우리가 서두에서 논의한 방식의 구성 공식으로 읽기 때문일 것입니다. 이번 장. 물은 실제로 미시적 구조와 거시적 특징을 모두 참조하는 것으로 특징지어집니다. 따라서 이것은 그 자체로 미시적 본질주의를 정당화할 수 없습니다.
이러한 이유로 미시적 필수주의적 주장은 화학적 분류 및 설명에 근거해야 합니다. IUPAC에서 개발한 명명 체계는 물질의 화학적 및 분광학적 거동에 대한 이론적 설명과 마찬가지로 전적으로 미시 구조를 기반으로 합니다(Hendry 2016 참조). 반면에 H 2 O 콘텐츠는 화학자와 다른 관심을 보이는 일반 언어 사용자의 "물"이라는 용어 사용을 추적하지 못합니다(Malt 1994). 다원주의는 이러한 긴장에 대한 한 가지 반응입니다. Hasok Chang(2012)은 과학 내에서도 물과 H2의 동일성을 촉구합니다 .O는 열려 있어야 합니다. Julia Bursten(2014)은 미세 본질주의의 실패와 화학에서 미세 구조의 특별한 역할을 조화시키려고 합니다. 그리고 Joyce Havstad(2018)는 화학자들의 물질 개념 사용이 생물학자들이 다양한 종 개념을 사용하는 것처럼 지저분하고 통합되지 않았다고 주장합니다.
5. 메커니즘 및 합성
지금까지 우리의 논의는 "정적" 화학, 즉 물질의 본성과 그 구조에 대한 설명에 초점을 맞추었습니다. 그러나 화학의 대부분은 물질의 한 형태에서 다른 형태로의 변형을 포함합니다. 이 섹션에서는 한 물질과 다른 물질의 합성을 둘러싼 철학적 문제와 화학 메커니즘, 화학자가 이러한 변환을 설명하는 데 사용하는 설명 프레임워크를 설명합니다.
5.1 화학에서의 기계적 설명
메커니즘 및 기계론적 설명의 개념에 대해 생물학 철학 및 신경과학 철학 문헌에서 많은 논의가 있었습니다(예: Machamer, Darden, & Craver 2000). 그러나 설명 체계로서의 메커니즘의 생성은 화학, 특히 유기 화학에서 원래의 고향을 찾습니다. 화학 메커니즘은 반응을 유형으로 분류하고, 화학적 거동을 설명하고, 새로운 상황에서 발생하는 새로운 반응이나 반응을 예측하는 데 사용됩니다(Weininger 2014).
Goodwin(2012)은 화학에서 작용하는 화학적 메커니즘의 두 가지 개념을 확인합니다. 메커니즘 의 첫 번째 또는 두꺼운 개념은 화학 반응의 영화와 같습니다. 이러한 메커니즘은 반응 과정에서 일부 분자 세트의 모든 전자 및 원자 코어의 위치를 추적하고 이러한 위치를 시스템의 위치 에너지 또는 자유 에너지와 연관시킵니다. 이것은 화학 반응의 시간 경과에 대한 모든 정보를 포함하기 때문에 이상적인 반응 메커니즘으로 생각할 수 있습니다.
대조적으로, 반응 메커니즘 의 얇은 개념은 개별 단계 세트에 초점을 맞춥니다. 각 단계에서 일련의 반응성 중간체가 생성됩니다. 이러한 중간체는 궁극적으로 반응 생성물을 생성하는 준안정 분자종입니다. 예를 들어, 많이 연구된 생체 분자 친핵성 치환( SN 2 ) 반응은 단일 반응성 중간체를 가지며 들어오는 친핵체와 나가는 이탈기가 모두 반응성 탄소 중심에 부분적으로 결합되어 있다고 합니다(그림 6 참조). 반응 메커니즘에 대한 이러한 설명은 많은 세부 사항을 생략한다는 점에서 추상적일 뿐만 아니라 매우 이상화되어 있습니다. 반응은 실제로 일련의 개별 단계로 일어나지 않으며, 각 단계는 준안정 반응 중간체를 생성합니다.
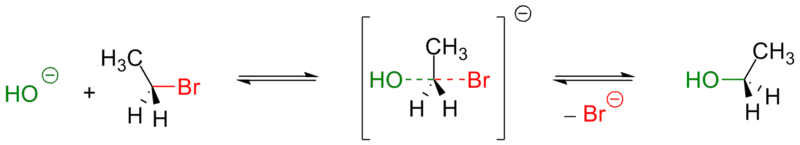
그림 6. SN 2 반응 에 대한 얇은 반응 메커니즘 .
반응 메커니즘에 대한 대부분의 교과서적인 설명은 두꺼운 개념을 언급하는 것으로 시작하지만 세부 사항은 거의 항상 메커니즘의 얇은 개념으로 바뀝니다. 동시에 반응 메커니즘에 대한 형식적인 이론적인 처리는 두꺼운 개념을 독점적으로 다룹니다. 이러한 처리는 종종 양자 역학에서 반응에 대한 위치 에너지 함수를 계산하려고 시도합니다. 공식 화학 이론화에 대한 두꺼운 개념의 중요성을 고려할 때 얇은 개념이 화학 실습을 지배하고 교과서 및 연구 기사에서 표현을 찾는 이유는 무엇입니까?
얇은 반응 메커니즘이 널리 사용되는 이유 중 하나는 두꺼운 반응 메커니즘을 결정하는 것이 실험적으로 본질적으로 불가능하고 이론적으로 매우 어렵기 때문입니다. 그러나 이것이 필요한 경우 화학자들이 두꺼운 메커니즘의 관련 부분을 생산할 수 있었기 때문에 이것이 전체 이야기가 될 수는 없습니다.
또는 Goodwin(2012, p. 311)은 화학자의 설명 및 예측 목표를 고려할 때 모든 두꺼운 메커니즘이 필요한 것은 아니라고 주장했습니다. 사실, 특정 구조의 특성화, 전이 상태 및 안정한 반응성 중간체만이 화학적 설명 및 예측을 생성하는 데 필요합니다. 안정 구조와 반응성 구조 사이의 개별적인 일련의 단계로 메커니즘을 구성하면 화학자가 다음을 수행할 수 있습니다.
... 이러한 표준 변경 중 어떤 것이 반응 진행에 대한 "병목"(또는 화학적 용어로 "속도 결정 단계")으로 작용하는지 식별하거나 지정하기 위해 ... 대체 경로가 있는 곳과 사용할 수 없는 곳을 명확히 ... 그리고] 메커니즘이 제안되고 있는 특정 반응에서 중요한 중간체의 구조에 대해 무엇인가를 추론하는 것(Goodwin 2012, p. 314).
따라서 화학자의 설명 목표는 반응 메커니즘의 특정 기능을 식별할 수 있어야 합니다. 나머지 두꺼운 메커니즘은 설명에 설명과 관련된 세부 사항을 반드시 추가하지는 않습니다.
5.2 반응 메커니즘의 확인
화학자는 일반적으로 자신의 작업에 대한 철학적 토론에 참여하지 않습니다. 그러나 반응 메커니즘의 확인을 논의할 때 확인을 둘러싼 철학적 문제에 대한 언급을 보는 것은 드문 일이 아닙니다. 그렇다면 반응 메커니즘에 대한 연구는 왜 화학자들을 더 철학적으로 성찰하게 만드는 것일까요?
우선 반응 메커니즘을 설명하기 위한 거의 모든 연구는 간접 기술에 의존합니다. 이상적으로, 반응 메커니즘을 설명하는 것은 생체 역학에서 실험을 하는 것과 같습니다. 슬로우 모션 비디오는 부분의 움직임과 이러한 움직임이 전체의 움직임을 일으키는 방법에 대한 직접적인 정보를 제공할 수 있습니다. 그러나 우리에게는 화학 반응용 비디오 카메라만한 것이 없습니다. 대신, 반응 생성물의 실험적 결정 및 안정한 중간 종의 가능한 분리 후 화학자들은 다른 기술 중에서 다양한 조건, 분광학 및 동위원소 표지에서의 반응 속도 측정에 의존합니다. 이러한 기술은 후보 반응 메커니즘을 제거하는 데 도움이 되지만 자체적으로 새로운 메커니즘을 제안하지는 않습니다. 가능성 제거에 대한 이러한 강조는 일부 화학자들로 하여금 Popperian을 지지하도록 이끌었습니다.
일부 화학자들은 반증주의적 분석에 끌렸지만 반응 메커니즘 설명에 대한 더 나은 분석은 제거 유도 로 알려진 확인의 설명입니다 . 이 설명은 가설을 거부하려는 반증의 강조점을 공유하지만, 거부되지 않은 가설은 어느 정도 확인을 받는다고 주장합니다. 따라서 반응 메커니즘의 경우 제거 유도를 화학자가 다음과 같은 과정으로 볼 수 있습니다.
- 반응 메커니즘에 대한 합리적인 후보를 열거하십시오.
- 이러한 메커니즘의 실험 결과를 고려하여 메커니즘을 테스트할 수 있는 반응 조건 목록을 작성합니다.
- 주어진 배경 조건 세트에 대해 적어도 두 가지 가설을 차등적으로 평가하는 실험을 고안합니다.
- 실험 결과와 일치하지 않는 것으로 나타난 반응 메커니즘 가설을 거부하고 이러한 실험을 수행합니다.
이 절차를 따르면 화학자들은 단순히 위조하는 것 이상을 수행합니다. 제거되지 않은 메커니즘에 확인하는 힘을 추가합니다. 실제로, 유사한 문제를 논의하면서 생화학자 John Platt(1964)는 좋은 과학적 추론은 강력한 추론 이며, 실험의 목표는 하나 이상의 가설을 제거하는 것이라고 주장했습니다. 몇몇 현대 철학자들은 과학에서 제거 귀납의 역할을 지지했습니다(예: Bird 2010, Dorling 1995, Kitcher 1993, Norton 1995). 확인을 위해 베이지안 및 기타 정량적 프레임워크에서 모델링할 수 있는 방법을 쉽게 알 수 있습니다. 특히, 특정 후보 반응 메커니즘이 제거됨에 따라 나머지 메커니즘 중 하나가 정확할 확률이 높아집니다(자세한 내용은 Earman 1992 참조).
제거 유도의 한 가지 어려움은 이 경우 반응 메커니즘과 관련된 대체 가설의 출처입니다. 이러한 메커니즘을 생성하기 위한 알고리즘 절차는 없으며 올바른 메커니즘이 전혀 고려되지 않았을 가능성이 항상 있습니다. 이것은 진정한 문제이며, 우리는 화학자들이 메커니즘에 대해 생각할 때 반증으로 향하도록 동기를 부여하는 바로 그 문제라고 믿습니다. 그들이 할 수 있는 일은 그들이 생각한 그럴듯한 메커니즘을 평가하는 것뿐입니다. 그러나 우리는 제거적 귀납법이 기계 화학자의 인식론적 상황을 보다 그럴듯하게 반영한다고 봅니다. 이 문제는 실험과 호환되는 메커니즘에 대한 불확실성이 아닙니다. 화학자들은 실험에 찬성하는 증거가 있습니다. 오히려 문제는 생각하지 못한 대안에 있습니다. 구조는 그러한 기계론적 가능성을 기술하는 한 가지 방법을 제공합니다. Hoffmann(1997, 29장)은 H. Okabe와 JR McNesby가 동위원소 표지를 사용하여 광분해에 대한 세 가지 가능한 메커니즘 중 두 개를 제거한 방법에 대한 논의에서 명시적으로 제거 추론의 아름다운 예를 제공합니다. 에탄에서 에틸렌으로. 그러나 이것은 기계 화학뿐만 아니라 과학의 모든 부분에서 문제이며 제거 귀납법은 구조에 대한 화학자의 추론에서 항상 역할을 해왔습니다. 반 호프는 사면체 탄소 원자에 대해 어떻게 주장했습니까? 그는 먼저 공간에서 원자의 배열을 고려함으로써 관찰된 특정 유기 물질의 이성질체의 수와 다양성을 설명하는 것이 가능하다고 주장했습니다. 그런 다음 그는 정사각형 평면 배열을 거부하여 탄소 원자의 사면체 기하학을 옹호했습니다. 탄소의 기하학적 구조가 정사각형 평면이라면 관찰된 것보다 더 많은 치환된 메탄 이성질체가 있을 것입니다. 따라서, 예를 들어, 이치환된 메탄(CH 형태의2 X 2 ) 정사각형 평면인 경우 두 개의 분리 가능한 이성질체가 있어야 하지만 하나만 찾을 수 있습니다. 대조적으로, 사면체 배열을 가정하면 관찰된 이성질체의 수와 일치할 것입니다(Brock 1992).
5.3 화학에서 발견의 논리
그의 고전적인 토론에서 Hans Reichenbach 는 발견 의 맥락과 정당화 의 맥락을 구분 했습니다. 그의 구별은 우리가 확증 이론의 형태로 과학적 정당성에 대한 논리적 분석을 할 수 있지만 가설을 생성하는 논리적 절차는 결코 있을 수 없다는 사실을 강조하기 위한 것이었습니다. 가설 생성은 과학의 창조적 부분이고 확인은 논리적 부분입니다. 이러한 구별은 정당화에 기여하는 발견의 경로를 보는 사람들에 의해 최근 몇 년 동안 도전을 받았습니다. 그러나 화학은 라이헨바흐에게 더 흥미로운 도전을 제공합니다. 그것은 분명히 우리에게 발견의 논리를 제공합니다.
화학자들이 때때로 발견을 위한 논리나 절차에 대해 말하는 두 가지 하위 분야가 있습니다. 첫 번째는 합성 화학입니다. EJ Corey(Corey & Cheng 1989)는 유기 분자의 합성이 역합성 분석 의 논리에 따라 합리적으로 계획될 수 있다고 제안했습니다 . 합성 유기 화학의 오랜 전통을 체계화한 Corey는 일련의 "연결 해제", 즉 만드는 방법을 알고 있는 결합을 찾아 표적 분자에서 거꾸로 추론할 수 있는 방법을 보여줍니다. 결과적으로 발생하는 연결 끊김 트리는 합성을 위한 잠재적인 경로를 제공하여 타당성으로 평가하거나 단순히 실험실에서 시도할 수 있습니다.
화학자들이 발견을 위한 논리를 개발한 또 다른 영역은 약물 설계 영역입니다. 예를 들어 Murray Goodman(Goodman & Ro 1995)은 신약 후보 물질을 개발하기 위한 4단계 절차를 제안했습니다. 뇌에 있는 모르핀 수용체 중 하나를 보다 효과적으로 표적으로 삼는 약물을 만드는 데 관심이 있다고 가정해 보겠습니다. 아마도 더 제한된 구조를 가진 모르핀의 분자 유사체를 만드는 것으로 시작합니다. 성공적인 합성 후에는 분광법과 컴퓨터 시뮬레이션을 통해 분자의 3차원 구조를 연구합니다. 그런 다음 생물학적 분석에서 분자를 테스트하여 수용체를 성공적으로 표적화했는지, 어느 정도까지 표적화했는지 확인합니다. 그런 다음 얻은 정보를 기반으로 구조를 수정하고 각 반복에서 개선되기를 바랍니다.
이러한 화학의 예는 발견의 논리가 있을 수 없다는 라이헨바흐의 주장에 압력을 가했습니다. 게다가 그들은 과학이 새로운 것을 창조하는 것과 관련이 있을 때 발견을 위한 절차가 필수적이 될 수 있음을 보여줍니다.
6. 화학적 환원
과학 철학의 다년생 주제 중 하나는 이론 간 관계에 관한 것입니다. 생물학이 물리학으로 환원될 수 있는지 또는 심리학이 생물학으로 환원될 수 있는지를 논의하는 과정에서 많은 철학자들은 화학이 이미 물리학으로 축소되었다고 가정합니다. 과거에는 이 가정이 너무 만연하여 마치 화학에서 물리학으로의 환원이 완료된 것처럼 "물리/화학적" 법칙과 설명을 읽는 것이 일반적이었습니다. 대부분의 화학 철학자들은 화학 과학과 물리학 사이에 충돌이 없다는 것을 인정하지만(Needham 2010b), 많은 사람들은 더 강력한 통일 이론을 거부합니다. 대부분의 사람들은 화학이 물리학으로 축소되지 않았으며 그럴 가능성도 없다고 생각합니다(반대 견해에 대해서는 Le Poidevin 2005, 재결합에 대해서는 Hendry & Needham 2007 참조).
화학에서 환원성에 대한 질문을 생각할 때, 이 질문을 두 부분으로 나누는 것이 유용합니다. 첫 번째이자 철학자들에게 더 친숙한 부분은 원소, 원자, 분자 및 물리학의 기본 입자 간의 관계에 관한 것입니다. "원자 및 분자 종은 양자 역학에 따라 상호 작용하는 기본 입자 시스템으로 환원될 수 있습니까?" 두 번째로 덜 친숙한 질문은 화학 물질에 대한 거시적 설명과 미시적 설명 간의 관계에 관한 것입니다. “화학물질은 분자종으로 환원될 수 있는가?” 여기서 주요 질문은 거시적으로 정의된 모든 화학적 특성이 원자, 분자 및 상호 작용의 특성 측면에서 재정의될 수 있는지 여부입니다.
6.1 분자종의 양자역학으로 환원
Bogaard(1978), Scerri(1991, 1994) 및 Hendry(1998)는 모두 원자와 분자에 대한 화학 이론을 양자 역학으로 완전히 환원할 가능성에 의문을 제기했습니다. Bogaard는 원자가 및 결합과 같은 많은 주요 화학 개념이 양자 역학에서 자연적 고향을 찾지 못한다고 주장합니다. 비슷한 정신으로 Scerri는 화학 교과서에 표준으로 제시된 원자 스펙트럼의 양자 역학 계산이 많은 전자 시스템의 구조에 대해 매우 이상적인 가정을 만든다고 지적합니다. 이러한 근사치는 실용적인 근거에서 동기를 부여합니다. 그러나 양자 역학이 화학적 사실을 "대략적으로 축소"하는 것을 허용하지 않습니다. 이러한 근사로 인해 발생하는 오류를 추정할 수 없기 때문입니다(Scerri 1991, 1994). 또한 가장 중요한 화학 트렌드 중 하나인 주기율표의 주기 길이는 실험적으로 파생된 화학 정보가 구체적으로 도입되지 않는 한 양자 역학에서 파생될 수 없습니다(Scerri 1997). Woolley(1978)와 Primas(1981)의 작업을 바탕으로 Hendry(1998)는 양자 역학 내에서 분자 모양을 수용하는 데 원칙적인 어려움이 있다고 주장합니다. Born-Oppenheimer 근사는 손으로 구조를 효과적으로 추가합니다. 양자 화학이 극도로 빛을 발할 수 있지만, 이 저자들은 그것이 화학을 물리학으로 환원하지 않았다고 주장합니다. Hendry(1998)는 양자 역학 내에서 분자 모양을 수용하는 데 원칙적인 어려움이 있다고 주장합니다. Born-Oppenheimer 근사는 손으로 구조를 효과적으로 추가합니다. 양자 화학이 극도로 빛을 발할 수 있지만, 이 저자들은 그것이 화학을 물리학으로 환원하지 않았다고 주장합니다. Hendry(1998)는 양자 역학 내에서 분자 모양을 수용하는 데 원칙적인 어려움이 있다고 주장합니다. Born-Oppenheimer 근사는 손으로 구조를 효과적으로 추가합니다. 양자 화학이 극도로 빛을 발할 수 있지만, 이 저자들은 그것이 화학을 물리학으로 환원하지 않았다고 주장합니다.
환원이 상위의 현상을 하위 수준에서 배타적으로 도출하는 것이라고 생각한다면 이러한 주장은 환원의 문제를 해결해야 합니다. 양자역학이 발견된 지 80년이 넘었지만 화학은 양자역학으로 축소되지 않았습니다. 그러나 이 주장에 대해 두 가지 가능한 환원주의적 반응이 있다.
첫째, 환원론자들은 화학 현상이 양자 역학에서 파생되지 않은 원칙적인 이유가 없다고 주장할 수 있습니다. 문제는 기본적인 것이 아니라 계산 능력과 적절한 근사 계획이 부족하다는 것입니다. Schwarz(2007)는 원자의 전자 구조, 따라서 주기율표가 원칙적으로 양자 역학에서 파생될 수 있다고 주장하면서 Scerri에 대해 이 주장을 했습니다. 그는 양자 화학의 화학적 특성 감소의 무능력은 단순히 계산적으로 복잡한 모든 과학이 공유하는 문제의 표현이라고 믿습니다. 그런 다음 논쟁은 그러한 "원칙적 환원 가능성" 주장의 타당성으로 바뀝니다.
적어도 암묵적으로 화학의 존재론에 초점을 맞추는 주장도 있습니다. 현대 형이상학의 잘 알려진 한 가닥은 우주의 모든 것이 물리적이라는 교리인 물리주의를 옹호합니다(물리주의 항목 참조 ) . 물리학자에 따르면, 화학 설명과 이론이 물리학에서 파생될 수 없음에도 불구하고 화학은 "아무것도 아닌" 물리학입니다. 물리적 세계는 단순히 물리학의 기본 입자로 구성됩니다. 화학 물질과 그 속성은 독립적인 실체가 없습니다.
물리주의에 대한 논증의 지위와 물리에 대한 모든 것의 수반은 고유한 형이상학 내에서 논쟁의 여지가 있지만 이 항목의 범위를 벗어납니다. 그러나 우리는 물리학에서 완전히 파생될 수 있는 화학 이론의 실패가 물리주의 교리에 대한 흥미로운 질문을 제기한다고 생각합니다. 최소한 물리적인 영역이 잘 정의되지 않는다는 오랜 우려를 나타냅니다. 분자나 이온과 같은 화학적 실체가 결국 물리적 존재론의 일부가 된다면, 이것은 화학이 물리학으로 환원된 경우가 아니라 단순히 물리학의 존재론이 화학의 존재론을 포괄하도록 확장된 경우라고 주장할 수 있습니다. .
여러 저자에 의해 mereology를 기반으로 한 화학의 존재론에 대한 독립적인 연구가 수행되었습니다(Earley 2005, Harré and Llored 2011, Needham 2010a). 궤도가 관찰되었다는 주장(Zuo et al. 1999)에 대한 Scerri(2000, 2001)의 주장을 논박하면서, Mulder(2010)는 적절하게 존재한다고 말할 수 있는 개체와 그렇지 않은 상태 사이의 일반적인 존재론적 구별에 호소합니다. t는 독립적으로 존재하지만 존재하는 개체의 기능입니다. Ostrovsky(2005)와 Schwarz(2006)는 Scerri의 주장에서 근사의 역할에 문제를 제기합니다.
더 논쟁의 여지가 있는 것은, 일부 화학 철학자들은 화학적 성질이 물리적 시스템의 행동을 제약할 수 있다고 주장했는데, 이는 정신 철학자가 강한 출현 또는 하향 인과 관계라고 부르는 것과 유사합니다(Kim 1999). Hendry는 구조를 이해하는 데 양자 역학의 중심 역할을 인정하면서 어떤 경우에는 분자 구조가 설명되지 않는 설명자라고 주장합니다. 문제는 구조 이성질체, 즉 원자는 같지만 분자 구조가 다른 분자에 대한 양자역학적 설명을 고려할 때 발생합니다. 예를 들어, 디메틸 에테르와 에탄올은 물리적 상태에 대한 양자 역학적 설명인 해밀턴을 공유합니다. 그럼에도 불구하고 그들은 매우 다른 분자입니다. 에탄올은 물에 극도로 용해되는 반면 디메틸 에테르는 물에 부분적으로만 용해됩니다. 에탄올은 78.4°C에서 끓는 반면 디메틸 에테르는 34.6°C에서 끓습니다. 에탄올을 마시면 중독이 되는 반면 디메틸 에테르는 전혀 다른 방식으로 독성이 있습니다. 양자 역학은 이러한 각 구조가 어떻게 에너지적으로 안정적인지 보여주고 다른 분자 및 방사선과 상호 작용하여 에탄올 및 디메틸 에테르의 화학적 및 분광학적 거동을 설명하지만 다른 구조는 설명할 수 없는 초기 조건으로 도입됩니다. 그는 이러한 사실이 구조가 환원될 수 있다는 주장과 양립할 수 없다는 것을 인정하지만, 강한 출현은 화학과 양자 역학 사이의 설명 관계의 축소만큼 그럴듯한 해석이라고 주장합니다(2006b, 2010a). 디메틸 에테르는 매우 다른 방식으로 독성이 있습니다. 양자 역학은 이러한 각 구조가 어떻게 에너지적으로 안정적인지 보여주고 다른 분자 및 방사선과 상호 작용하여 에탄올 및 디메틸 에테르의 화학적 및 분광학적 거동을 설명하지만 다른 구조는 설명할 수 없는 초기 조건으로 도입됩니다. 그는 이러한 사실이 구조가 환원될 수 있다는 주장과 양립할 수 없다는 것을 인정하지만, 강한 출현은 화학과 양자 역학 사이의 설명 관계의 축소만큼 그럴듯한 해석이라고 주장합니다(2006b, 2010a). 디메틸 에테르는 매우 다른 방식으로 독성이 있습니다. 양자 역학은 이러한 각 구조가 어떻게 에너지적으로 안정적인지 보여주고 다른 분자 및 방사선과 상호 작용하여 에탄올 및 디메틸 에테르의 화학적 및 분광학적 거동을 설명하지만 다른 구조는 설명할 수 없는 초기 조건으로 도입됩니다. 그는 이러한 사실이 구조가 환원될 수 있다는 주장과 양립할 수 없다는 것을 인정하지만, 강한 출현은 화학과 양자 역학 사이의 설명 관계의 축소만큼 그럴듯한 해석이라고 주장합니다(2006b, 2010a). 에탄올과 디메틸 에테르의 화학적 및 분광학적 거동을 설명하기 위해 다른 분자 및 방사선과 어떻게 상호 작용하는지 조명하지만 설명되지 않은 초기 조건으로 다른 구조가 도입됩니다. 그는 이러한 사실이 구조가 환원될 수 있다는 주장과 양립할 수 없다는 것을 인정하지만, 강한 출현은 화학과 양자 역학 사이의 설명 관계의 축소만큼 그럴듯한 해석이라고 주장합니다(2006b, 2010a). 에탄올과 디메틸 에테르의 화학적 및 분광학적 거동을 설명하기 위해 다른 분자 및 방사선과 어떻게 상호 작용하는지 조명하지만 설명되지 않은 초기 조건으로 다른 구조가 도입됩니다. 그는 이러한 사실이 구조가 환원될 수 있다는 주장과 양립할 수 없다는 것을 인정하지만, 강한 출현은 화학과 양자 역학 사이의 설명 관계의 축소만큼 그럴듯한 해석이라고 주장합니다(2006b, 2010a).
6.2 물질을 분자종으로 환원
지금까지 우리는 화학과 물리학 사이의 이론 간 관계를 고려했습니다. 화학 자체 내에서는 어떻습니까? 거시적 화학 이론과 미시적 화학 이론이 완벽하게 일치합니까? 물질의 모든 거시적 특성은 궁극적으로 미시적 특성으로 환원될 수 있습니까? 다시 말해, 물질에 대한 거시적 설명과 물질의 거동에 대한 열역학 이론이 있다면 이 모든 것을 분자적 설명으로 축소할 수 있습니까? 많은 철학자들과 화학자들에게 그 대답은 "예"인 것처럼 보였으나, 화학 철학자들은 여기서 주의를 촉구했습니다.
가스 분자의 평균 운동 에너지로 환원될 수 있다고 종종 가정되는 비교적 단순한 가스 온도의 경우를 먼저 고려하십시오(cf. Nagel 1961, p. 343). 그러나 분자의 특정 평균 운동 에너지는 주어진 온도를 갖는 데 필요한 조건일 뿐입니다. 모든 공간 부분이 전체와 동일한 온도를 가질 때 평형 상태에 있는 기체만 일정한 온도를 갖습니다(온도가 집중 속성이라는 사실을 반영함). 충분한 조건은 열역학적 평형 상태에 있는 거시적 조건의 미시적 상관 관계로 평균 운동 에너지를 보완해야 합니다. 통계 역학은 볼츠만 분포에 따라 기체 분자에 에너지가 분포하는 것과 같은 관련 상관 조건을 지정합니다. 그러나 Boltzmann 분포는 온도의 함수로 표현되며, Boltzmann의 엔트로피 미시적 해석에서 파생된 것은 엔트로피와 온도를 연결하는 열역학 법칙에 호소합니다. 따라서 기체 온도의 필요충분조건은 온도 개념의 축소로 해석하면 원형이 된다(Needham 2009b; Bishop 2010).
미시적 특성으로 온도를 낮추는 것은 문제가 있지만 상대적으로 감소하기 쉬운 후보입니다. 상전이, 용해도 및 반응성과 같은 화학적 변화와 관련된 속성은 훨씬 더 복잡합니다. 4.5절에서 논의한 바와 같이 물질에 대한 순전히 미시적인 설명은 모든 화학적 특성과 같은 범위에 걸쳐 있지 않습니다. 예를 들어 용해도는 미시적 특성으로 완전히 설명되지 않습니다. 물질의 이온이나 분자가 서로보다 용매에 더 친화력이 높을 때 물질이 용해된다는 것을 대략적인 정성적 방식으로 설명할 수 있지만, 이것은 용해도의 미묘하고 정량적인 특징을 회복하지 못합니다. 또한 비이온성 물질의 용해도를 그대로 유지합니다. 이러한 특성을 예측하려면 열역학에 대한 호소가 필요하며,
이 사례에서 보았듯이 미시적 수준에서 물리 및 화학 이론을 매우 유익한 적용을 해도 화학적으로 중요한 특성을 줄이기에는 충분하지 않은 경우가 많습니다. 화학 물질의 일반적인 개념이나 알려진 수백만 가지 물질 각각에 대한 특정 물질의 특성이 미세 구조로 환원될 수 있는지 여부는 단순히 가정하는 것이 아니라 입증되어야 합니다. 환원이 항상 불가능하다는 원칙적인 주장은 없지만, 우리가 알고 있는 모든 공식적인 환원 시도에서 거시적으로 관찰할 수 있는 화학적 성질에 대한 필수 참조가 이루어집니다. 이에 대한 명확한 반대 주장이 없는 한, 화학이 통일된 관점으로 통합하기 위해 노력하는 상세한 이론에서 거시적 개념과 미시적 개념을 모두 사용한다고 가정하는 것이 합리적으로 보입니다. 미시적 수준에서만 많은 화학이 수행되지만 거시적 화학적 특성은 화학 전반에 걸쳐 중요한 실험적 및 이론적 역할을 계속 수행합니다.
화학적 환원에 대한 이러한 모든 논쟁의 배경에는 성공적인 환원의 기준에 관한 문제가 있습니다. 우리가 논의한 모든 문헌은 환원에 대한 Nagel의 영향력 있는 설명을 명시적 또는 암시적으로 언급합니다. 화학 문헌의 철학을 넘어서, 이 설명은 특정 과학에 대한 Nagel 설명의 적용 불가능성에 대해 지적할 때에도 특정 환원주의 테제(예: Davidson 1970)의 비평가들에 의해 전제되었습니다. 그러나 Nagel의 환원에 대한 설명은 가정하는 논리적 요구 사항 때문에 많은 사람들이 비현실적이고 실제 과학에 적용할 수 없다고 생각합니다.
아마도 화학 문헌 철학에서 반환원주의적 합의의 일부는 Nagel 설명의 엄격한 요구에 의해 주도될 것입니다. 그러나 Nagel의 설명이 대략적인 논증을 허용하도록 약화되더라도(Hempel이 설명의 DN 모델을 수정한 것처럼) 일부 환원주의 옹호자들이 주장한 것처럼(예: Schaffner 1967; Churchland 1985), 이것은 여전히 항소 문제를 우회하지 못합니다. 미시적 특성에 대한 설명에서 거시적 특성으로. 현재의 화학 이론은 화학적 및 양자 역학적 기원을 가진 미시적 화학적 개념과 거시적 화학 개념 모두를 필수적으로 참조합니다. 우리는 이러한 측면 중 하나가 완전히 제거된 설득력 있는 실질적인 예를 알지 못합니다.
7. 모델링 및 화학적 설명
거의 모든 현대 화학 이론화에는 모델링, 모델을 통한 실제 화학 현상의 간접 설명 및 분석이 포함됩니다. 19 세기 부터 화학은 일반적으로 분자 구조의 물리적 모델과 함께 가르치고 연구되었습니다. 20세기부터 고전 역학과 양자역학에 기반한 수학적 모델이 화학 시스템에 성공적으로 적용되었습니다. 이 섹션에서는 화학 모델링을 보다 직접적으로 고려할 때 발생하는 몇 가지 철학적 질문에 대해 논의합니다.
7.1 물리적 모델링
화학의 모델링 전통은 원자와 분자의 물리적 모델에서 시작되었습니다. 현대 화학 교육에서는 그러한 모델의 구성과 조작에 많은 중점을 둡니다. 유기 화학 수업의 학생들은 종종 플라스틱 분자 모델링 키트를 구매해야 하며 전문 실험실 환경에서 이러한 키트로 구성된 복잡한 분자 구조를 보는 것은 드문 일이 아닙니다.
분자 모델의 사용은 19 세기 중반에 특별한 주목을 받아 화학자들이 분자 모양의 중요성을 이해하는 데 도움이 되었습니다(Brock 2000). 이러한 구조는 종이에 표현될 수 있지만, 물리적 모델은 스케치만으로는 제공하지 못하는 즉각성과 시각화의 용이성을 제공했습니다. 20세기 중반에 DNA의 이중 나선 구조의 발견은 물리적 모델의 조작에 의해 도움을 받았습니다(Watson 1968).
7.2. 수학적 모델링
물리적 모델링은 역사적으로 중요했고 여전히 화학 교육 및 입체화학 연구의 중심 부분이지만 현대 화학 모델은 거의 항상 수학적입니다. 원자가 결합, 분자 궤도 및 반경험적 모델 과 같은 부분적으로 중첩되고 부분적으로 호환되지 않는 모델의 패밀리는 분자 구조 및 반응성을 설명하고 예측하는 데 사용됩니다. 분자 역학 모델은 반응 역학 및 수송 과정의 일부 측면을 설명하는 데 사용됩니다. 그리고 격자 모델은 위상과 같은 열역학적 특성을 설명하는 데 사용됩니다. 이러한 모델과 기타 수학적 모델은 화학 교과서와 기사에서 흔히 볼 수 있으며 화학자들은 이를 화학 이론의 핵심으로 봅니다.
화학자들은 어떤 종류의 수학적 구조가 모델이 될 수 있는지에 대해 매우 관대합니다. 그러나 거의 모든 종류의 수학적 구조가 화학 모델의 역할을 할 수 있지만 다양한 유형의 시스템은 모델링에 사용되는 특정 수학적 구조에 적합합니다. 예를 들어, 양자 화학에 사용되는 가장 일반적인 수학적 구조는 상태 공간이며, 일반적으로 분자 이하 입자 거리와 화학 시스템의 총 에너지를 연관시킵니다. 화학 모델링의 다른 부분은 동적이므로 시간 경과에 따른 반응 과정을 나타낼 수 있는 궤적 공간을 사용합니다. 그래프 및 그룹과 같은 다른 종류의 수학적 구조를 사용하여 분자 구조 및 대칭을 모델링할 수 있습니다.
화학 모델링에서 많은 연습의 목적은 실제 시스템에 대해 배우는 것입니다. 이러한 경우 모델은 실제 시스템과 특정 관계를 유지해야 합니다. 그러나 이러한 관계가 항상 매우 충실할 필요는 없습니다. 예를 들어, Linus Pauling(1939)과 단순 원자가 결합 모델의 초기 지지자들은 이 모델이 화학적 결합을 일으키는 필수적인 물리적 상호 작용을 포착했다고 믿었습니다. 이 방법은 결합에 대한 루이스의 개념과 밀접하게 관련되어 있으며, 분자를 원자핵(내부 껍질 전자와 함께 핵)과 국부 결합을 발생시키는 원자가 전자로 구성된 것으로 취급합니다. 이는 결합 전자를 분자의 특정 부분에 국한시키지 않는 분자 궤도법과 대조적입니다. 현대 양자 화학자들은 원자가 결합 모델을 더 복잡한 모델을 구축하기 위한 템플릿으로 생각합니다. 따라서 현대 양자 화학자가 실제 분자를 연구하기 위해 간단한 원자가 결합 모델을 사용한다면 그녀는 Pauling보다 훨씬 낮은 수준의 충실도로 그렇게 합니다. 그녀의 모델 사용은 시스템의 가장 중요한 기능에 대한 첫 번째 근사치를 제공하기 위한 것입니다.
7.3. 모델링 및 설명
화학에 대한 현대 이론 연구의 대부분은 화학에 양자 역학을 적용하는 것과 관련이 있습니다. 화학 현상의 양자 역학 설명에 대한 정확한 솔루션은 달성되지 않았지만 이론 물리학, 응용 수학 및 계산의 발전으로 인해 많은 분자의 화학적 특성을 매우 정확하고 거의 이상화하지 않고 계산할 수 있었습니다. 이상화 수준을 낮추면서 훨씬 더 정확한 계산을 위해 노력하는 접근 방식은 많은 양자 화학자들에 의해 지지됩니다. 예를 들어, 양자 화학 계산을 수행하는 주요 패키지 중 하나인 Gaussian의 개발 팀은 이러한 입장을 명시적으로 지지합니다. 그들은 어떤 계산을 위한 근사의 정도 또는 "이론의 수준"의 선택에 들어가는 많은 고려 사항이 있음을 인정하지만, 목표는 가능한 한 모델을 비이상화하는 것입니다. 그들은 정확한 해에 임의로 가까운 양자 화학 계산이 "모든 근사 방법이 노력하는 한계"라고 주장합니다(Foresman & Frisch 1996).
화학 이론을 발전시키는 이 방법은 이론의 체계적인 개선에 의존하여 이론을 진리에 더 가깝게 만들려고 시도합니다. 과학 철학자들은 이 과정 을 갈릴레오의 이상화 라고 불렀 습니다. 갈릴레오의 작업에서처럼 이상화는 다루기 쉬운 이유로 도입되고 가능한 한 빨리 제거되기 때문입니다(McMullin 1985; Weisberg 2007b). 그러나 모든 화학자들이 보다 정확한 계산에 대한 이러한 초점을 공유한 것은 아닙니다. 이론가 Roald Hoffmann은 자신의 경력에서 왜 이 길을 선택하지 않았는지에 대해 다음과 같이 썼습니다.
저는 다른 방향으로 전환하여 계산기에서 ... 설명가, 간단한 분자 궤도 모델의 제작자로 이동했습니다 ... [그리고] 실제로 [이런] 종류의 작업 ... 현상 분석에 대한 이전보다 더 깊은 필요가 있다고 느낍니다. 자신의 분야 내에서 동등한 복잡성의 다른 개념과의 관계를 봅니다(1998).
이 기사의 다른 곳에서 Hoffmann은 양자 화학이 예측 능력에서 엄청나게 성공적임을 인정하고 기본 이론에 대한 더 나은 근사치를 계속해서 제공합니다. 그러나 이 단락에서 표현된 태도는 화학 이론화를 위해 간단하고 이상적인 모델이 필요하다는 것 같습니다. 따라서 핵심 철학적 질문이 발생합니다. 진실에 더 가까운 모델의 가용성을 고려할 때 왜 이상적인 모델과 함께 작업해야 할까요?
한 가지 대답은 물리 유기 화학자인 Felix Carroll이 제공한 것입니다.
그렇다면 왜 우리는 높은 수준의 이론적 계산에 대해 이야기하고 간단한 이론을 무시하지 않습니까? 우리는 계산 목적을 위해 충분히 정확하면서도 모델이 설명하는 것을 어느 정도 이해할 수 있을 만큼 충분히 간단한 모델을 선택해야 합니다. 그렇지 않으면 모델은 블랙박스이고 우리는 그것이 하는 일을 이해하지 못하며, 아마도 그것이 생성하는 답변이 물리적으로 합리적인지 여부조차 모를 것입니다(Carroll 1998).
Carroll은 이러한 문제에 대해 자세히 설명하지 않지만 이 구절에는 핵심 메시지가 포함되어 있습니다. 단순한 모델은 우리의 이론이 "블랙박스" 특성을 갖는 것을 방지합니다. Carroll은 화학 현상이 발생하는 메커니즘을 밝히기 위해서는 간단한 모델이 필요하다고 주장합니다. 높은 수준의 이론적 계산은 시스템의 기본 물리학을 설명하는 양자 역학 원리에 기반하더라도 이러한 기계적 관계를 보여줄 수 없습니다. 또는 Hoffmann이 요점을 제시한 것처럼 "이해를 추구한다면 모든 관찰 가능한 것을 상세하게 예측하는 데 반드시 최고는 아니지만 더 단순한 모델이 가치가 있을 것입니다. 그러한 모델은 중요한 원인과 경로를 강조할 수 있습니다.”(Hoffmann, Minkin, &
단순 모델이 다른 모델보다 블랙박스 특성이 적은 경우가 있는 이유는 무엇입니까? 한 가지 설명은 우리의 인지적 한계에 호소합니다. 우리는 한 번에 몇 단계의 논쟁만 마음에 담을 수 있습니다. 최신 고급 계산은 빠른 컴퓨터를 사용하여 계산하는 데 몇 시간 또는 며칠이 걸릴 수 있습니다. 컴퓨터가 모든 단계를 명시한다고 해도 계산 단계를 염두에 두는 것은 불가능하므로 정답을 확신하더라도 결과에 대한 이유를 이해하기 어렵습니다. Paul Humphreys는 이것을 시뮬레이션의 인식적 불투명성 이라고 불렀습니다 (2004).
화학에서 단순하고 보다 고도로 이상적인 모델을 사용하는 두 번째 이유가 있습니다. 이는 설명적인 화학 전통에서 비롯됩니다. 이 점을 발전시키면서 Hoffmann은 화학 시스템을 지시할 수 있는 두 가지 설명 모드가 있다고 주장합니다: 수평 및 수직 (Hoffmann 1997). 수직적 설명은 과학 철학자들이 연역적 명목 론적이라고 부르는 것입니다.설명. 이들은 양자 역학에서 발생을 유도하여 화학 현상을 설명합니다. 양자 화학의 계산은 종종 예측을 하는 데 사용되지만 화학 현상을 설명하는 한 이러한 패턴을 따릅니다. 분자 구조가 안정적이라는 것을 보여줌으로써 양자 화학자는 기본 물리학을 고려할 때 이 구조가 예상되어야 한다고 추론하고 있습니다.
수직적 설명 방식과 대조적으로 수평적 설명 방식은 화학 현상을 화학 개념으로 설명하려고 시도합니다. 예를 들어, 모든 1학년 유기화학 학생들은 SN 2 반응 을 겪는 다양한 기질의 상대 반응 속도에 대해 배웁니다 . 유기 화학자는 "메틸 브로마이드가 메틸 클로라이드보다 SN 2 반응을 더 빠르게 진행하는 이유는 무엇입니까?"라고 물을 수 있습니다. 한 가지 대답은 "이탈기 Br - 는 Cl - 보다 약한 염기 이며 모든 것이 동일할 때 더 약한 염기가 더 나은 이탈기"라는 것입니다. 이것은 화학적 성질, 이 경우에는 염기의 약점에 호소하여 화학 반응을 설명합니다.
호프만은 수평적 설명과 수직적 설명의 다른 가치에 대해 별로 말하지 않았지만 한 가지 중요한 차이점은 그들이 우리에게 다른 종류의 설명 정보를 제공한다는 것입니다. 수직적 설명은 화학 현상이 양자 역학에서 파생될 수 있음을 보여줍니다. 그들은 양자 역학의 (대략적인) 진실을 고려할 때 관찰된 현상이 일어났어야 함을 보여줍니다. 수평적 설명 은 경향을 설명할 수 있는 대조적 설명 에 특히 좋습니다 . SN 2 반응 속도의 예를 다시 고려하십시오 . Br의 약점을 어필하여 -염기로서 화학자는 다른 분자에 걸쳐 공유되는 화학적 특성을 불러옵니다. 이를 통해 그녀는 메틸 클로라이드, 메틸 플루오라이드, 메틸 요오다이드 등과 비교하여 메틸 브로마이드의 반응성을 설명할 수 있습니다. 화학자들이 추세를 설명하려는 한, 화학 개념을 사용하여 대조적인 설명을 합니다.
저명한 화학 이론가인 Charles Coulson(1910-1974)은 화학 이론화의 본질을 반영하여 비슷한 점을 지적합니다. 그가 썼다:
양자 화학의 역할은 이러한 개념을 이해하고 화학적 거동의 본질적인 특징이 무엇인지 보여주는 것입니다. [화학자들]은 F-F 결합이 약한데도 왜 H-F 결합이 그렇게 강한지 알고 싶어합니다. 그들은 분광기 또는 물리 화학자가 측정을 하도록 하는 데 만족합니다. 그들은 양자 역학이 그 차이가 존재하는 이유를 설명할 것이라고 기대합니다. … 따라서 설명은 컴퓨터가 [결합의 길이가 서로 다름]을 보여준다는 것이어서는 안 됩니다. 왜냐하면 이것은 전혀 설명이 아니라 단지 실험의 확인이기 때문입니다(Coulson 1960, p. 173).
Coulson, Carroll, Hoffmann은 수평적 설명을 생성하기 위해 단순하고 이상화된 모델의 사용을 옹호하지만 양자 계산이 대조적 설명을 생성할 수 없다는 것은 분명하지 않습니다. 단일 수직 설명은 대조적이지 않지만 이론가는 여러 계산을 수행할 수 있으며 그렇게 함으로써 대조 설명을 만드는 데 필요한 정보를 생성할 수 있습니다. 양자 화학의 가장 좋은 예에는 화학적으로 관련된 경향을 파악하기 위한 일련의 밀접하게 관련된 계산이 있습니다.
서지
- Aristotle [ DG ], On Generation and Corruption ( De Generatione et Corruptione ), in The Complete Works of Aristotle (Volume 1), J. Barnes (ed.), Princeton: Princeton University Press, 1984, 512–554.
- Aristotle, On the Heavens ( De Caelo ), in The Complete Works of Aristotle (Volume 1), J. Barnes (ed.), Princeton: Princeton University Press, 1984, 447–511.
- Atkins, PW, 1991, 두 번째 법칙 , 뉴욕: 프리먼.
- Bader, RFW, 1991, 분자의 원자 , Oxford: Clarendon Press.
- –––, 2009, “결합 경로는 화학 결합이 아닙니다.” 물리 화학 저널 A , 113: 10391–10396.
- Berson, J., 2008, "매우 약한 결합을 가진 분자: 공유성의 가장자리" 과학 철학 , 75: 947–957.
- Berzelius, Jacob, 1813, "Azote, 수소, 암모니아의 성질과 Azote가 민감한 산화 정도에 관한 실험", Annals of Philosophy , 2: 276–86, 357–68.
- –––, 1815, “화학 비율의 법칙을 조사하려는 화학자에게 보내는 연설”, Annals of Philosophy , 5: 122–131.
- Biggs, Norman L., E. Keith Lloyd 및 Robin J. Wilson, 1976, 그래프 이론 1736–1936 , Oxford: Clarendon Press.
- Bird, Alexander, 2010, "Eliminative Induction: Examples from Medicine", Studies in History and Philosophy of Science , 41: 345–52.
- Bishop, Robert C., 2010, "화학은 어디에서?", 현대 물리학의 역사 및 철학 연구 , 41: 171–177.
- Bogaard, Paul A., 1978, "화학 환원제로서의 물리학의 한계", Proceedings of the Philosophy of Science Association (PSA 1978), 2: 345–56.
- Bréhier, Émile, 1951, Chrysippe et l'ancien stoïcisme , 2판, Presses Universitaires de France, Paris.
- Brock, WH, 2000, The Chemical Tree: A History of Chemistry , New York: WH Norton.
- Brush, Stephen, 1999a, "화학의 이론 변화의 역학: 벤젠 문제 1865-1945", 과학의 역사 및 철학 연구 , 30: 21-79.
- –––, 1999b, “화학에서 이론 변화의 역학: 벤젠과 분자 궤도, 1945–1980”, 과학의 역사 및 철학 연구 , 30: 263–302.
- Bursten, Julia, 2014, "본질주의가 없는 미세 구조: 화학 분류에 대한 새로운 관점", 과학 철학 , 81: 633–53.
- Carpenter, B., 1984, 유기 반응 메커니즘의 결정 , 뉴욕: John Wiley 및 Sons.
- Carroll, FA, 1998, Perspectives on Structure and Mechanism in Organic Chemistry , Pacific Grove: Brooks/Cole.
- Cerpa, Erick, A. Krapp, A. Vela 및 G. Merino, 2008, "결합 경로의 외부 전위에 대한 외부 대칭의 의미", 화학: 유럽 저널 , 14: 10232–10234.
- Chalmers, Alan, 1993, "Boyle의 기계적 철학의 우수성 부족", 역사 및 과학 철학 연구 , 24: 541–564.
- –––, 2002, “Robert Boyle의 작업에서 기계 철학과 실험 비교: Anstey와 Pyle에 대한 답변”, 역사 및 과학 철학 연구 , 33: 191–7.
- –––, 2005a, "17세기부터 20세기까지의 원자론", The Stanford Encyclopedia of Philosophy (2005년 가을 판), Edward N. Zalta(ed.), URL = < https://plato.stanford.edu/ archives/fall2005/entries/atomism-modern/ >.
- –––, 2005b, “Transforming Atomic Chemistry into Experimental Science: Dalton's Theory의 한계”, The Rutherford Journal , 1 [ 온라인에서 사용 가능 ].
- –––, 2008, “19세기 물리 과학의 원자론과 에테르”, 화학 기초 , 10: 157–66.
- –––, 2009, 과학자의 원자와 철학자의 돌: 과학이 성공하는 방법과 철학이 원자에 대한 지식을 얻는 데 실패한 방법 (Boston Studies in the Philosophy of Science, Vol. 279), Dordrecht: Springer.
- 장하석, 2012, 물은 H2O 인가 ? 증거, 현실주의 및 다원주 의(과학 철학의 보스턴 연구, Vol. 293), Dordrecht: Springer.
- Churchland, P, 1985, “환원, 질 및 직접적인 자기 성찰,” Journal of Philosophy , 82: 8–28.
- Cooper, J., 2004, "혼합에 관한 Aristotle에 대한 두 가지 메모", J. Cooper, 지식, 자연 및 선 에서, Princeton: Princeton University Press.
- Corey, EJ 및 X. Cheng, 1989, 화학 합성의 논리 , 뉴욕: Wiley.
- Coulson, CA, 1952, "화학 결합이란 무엇입니까?", Royal College of Science의 과학 저널 , 21: 11–29.
- –––, 1960, “분자 구조 계산의 현재 상태”. 현대 물리학의 리뷰 , 32: 170–177.
- Crum Brown, Alexander, 1864 [1865], "이성체 화합물 이론", 에딘버러 왕립 학회의 거래 23, 707–19. 페이지 참조는 Journal of the Chemical Society , 18: 230–45의 1865년 재판에 대한 것입니다.
- Davidson, Donald, 1970, "Mental Events", L. Foster and JW Swanson (eds.), Experience and Theory , Duckworth, London; Davidson 1980, pp. 207–25에서 재인쇄됨.
- –––, 1980, 행동 및 사건에 관한 에세이 , 뉴욕: 옥스포드 대학 출판부.
- Deltete, Robert J., 2000, 에너지학의 역사적 발전 , trans. G. Helm, Die Energetik nach ihrer geschichtlichen Entwicklung , Veit & Comp., Leipzig, 1898, Kluwer, Dordrecht.
- Dorling, J., 1995, "Einstein의 발견 방법론은 현상에서 뉴턴적 연역", J. Leplin(ed.), Creation of Ideas in Physics , Dordrecht: Kluwer, 97–112.
- Duhem, Pierre, 1892, "Notation atomique et hypothèses atomistiques", Revue des Questions scientifiques , 31, 391–457; Paul Needham이 "Atomic Notation and Atomistic Hypotheses"로 번역(원본 페이지 매김 포함), Foundations of Chemistry , 2(2000): 127–180.
- –––, 1902, Le mixte et la combinaison chimique: Essai sur l'évolution d'une idée , C. Naud, Paris; 1985년 파리에서 재인쇄된 Fayard. Duhem에서 번역됨(2002).
- –––, 2002, 혼합물 및 화학 조합 및 관련 에세이 , Paul Needham, Kluwer, Dordrecht 번역 및 편집.
- Earley, Joseph E., 2005, “왜 바다에는 소금이 없는가”, 기초 화학 , 7: 85–102.
- Earman, J., 1992, Bayes 또는 Bust? 캠브리지, MA: MIT Press.
- Einstein, Albert, 1905 [1956], 브라운 운동 이론에 대한 조사, Dover Books, New York.
- Emerton, Norma E., 1984, The Scientific Reinterpretation of Form , Cornell University Press, Ithaca, New York.
- Feynman, RP, 1939, "분자의 힘", Physical Review , 56: 340–3.
- Fine, K., 1995, "혼합의 문제", Pacific Philosophical Quarterly , 76: 266–369.
- Finney, John L., 2004, “물? 무엇이 그렇게 특별한가?”, 런던 왕립 학회의 철학적 거래 B , 359: 1145–1165.
- Foresman, JB, & Frisch, A., 1996, 전자 구조 방법을 사용한 화학 탐구 , 두 번째 판, 피츠버그: Gaussian, Inc.
- Fox, Robert, 1971, 가스의 열량 이론: Lavoisier에서 Regnot까지 , Clarendon Press, Oxford.
- Geoffroy, Etienne François, 1718 [1996], "다른 물질 사이의 화학에서 관찰된 다른 관계의 표", 문맥 과학 , 9: 313–20.
- Gibbs, JW, 1948, "이질적인 물질의 평형에 관하여", J. Willard Gibbs의 수집된 작품 , Vol. I (pp. 55–353), Yale University Press, New Haven. ( Transactions of the Connecticut Academy of Arts and Sciences , 3: 1876–1878, 108–248, 343–520에서 처음 출판됨; 이 판은 1906년에 처음 출판됨).
- Gillespie, Ronald J. 및 Paul LA Popelier, 2001, 화학 결합 및 분자 기하학: 루이스에서 전자 밀도까지 , Oxford University Press, Oxford.
- Goodman, M 및 S. Ro, 1995, "약물 디자인을 위한 펩티드 모방체", Burger's Medicinal Chemistry and Drug Discovery, Vol. I (Eds.: ME Wolff), John Wiley & Sons, Inc., 803–861.
- Goodwin, W., 2012, "Mechanisms and Chemical Reactions," Handbook of the Philosophy of Science, Vol 6: Philosophy of Chemistry , R. Hendry, P. Needham 및 A. Woody(eds.), Amsterdam: Elsevier, 301 -327.
- Harré, Rom 및 Jean-Pierre Llored, 2011, "화학 담론의 문법으로서의 Mereologies", 기초 화학 , 13: 63–76.
- Havstad, Joyce C., 2018, "더러운 화학 종류", 영국 과학 철학 저널 , 69: 719–743
- Hempel, CG, 1965, "과학적 설명의 측면", 과학적 설명의 측면 , 자유 언론, Collier-Macmillan, 토론토; 331~496쪽.
- Hendry, Robin Findlay, 1998, "Models and Approximations in Quantum Chemistry", Niall Shanks (ed.), Idealization IX: Idealization in Contemporary Physics (Poznan Studies in Philosophy of the Sciences and the Humanities, Vol. 63), Amsterdam : 로도피; 123–42.
- –––, 2005, “원소에 관한 Lavoisier와 Mendeleev”, 기초 화학 , 7: 31–48.
- –––, 2006a, “원소, 화합물 및 기타 화학 종류”, 과학 철학 , 73: 864–75.
- –––, 2006b, "화학에 하향 인과 관계가 있습니까?", Davis Baird, Eric Scerri 및 Lee McIntyre, eds., Philosophy of Chemistry: Synthesis of New Discipline (Boston Studies in Philosophy of Science), Dordrecht: 스프링거, 173–89.
- –––, 2008, "화학 결합의 두 가지 개념", 과학 철학 , 75(5): 909–920.
- –––, 2010a, “존재론적 환원과 분자 구조”, 현대 물리학의 역사와 철학 연구 , 41: 183–191.
- –––, 2010b, "화학 결합: 구조, 에너지 및 설명", Mauro Dorato, Miklos Redei 및 Mauricio Suarez(편), EPSA: 과학의 철학적 문제: 유럽 과학 철학 협회 출범 , 베를린 : 스프링거, 117–27.
- –––, 2010c, “엔트로피와 화학물질”, 과학철학 , 77: 921–32.
- –––, 2016, "화학의 자연 종류", Grant Fisher 및 Eric Scerri(편저), 화학 철학 에세이 , Oxford: Oxford University Press, 253–75.
- Hendry, Robin Findlay 및 Paul Needham, 2007, "화학 감소에 관한 Le Poidevin", 영국 과학 철학 저널 , 58: 339–53.
- Hoffmann, R., 1997, 동일 및 동일하지 않음 , 뉴욕: Columbia University Press.
- –––, 1998, “현대 전산 화학 시대의 질적 사고–또는 Lionel Salem이 알고 있는 것”. 분자 구조 저널 , 424: 1–6.
- Hoffmann, R., Minkin, VI, & Carpenter, BK, 1996, "Ockham의 면도날과 화학". Bulletin de la Société Chimique de France , 133: 117–130.
- Humphreys, P., 2004, Extending Ourselves , 뉴욕: Oxford University Press.
- 키처, 필립, 1984, “1953 그리고 그 모든 것. A Tale of Two Sciences”, Philosophical Review , 93: 335–73.
- –––, 1993, 과학의 발전 , 뉴욕: 옥스포드 대학 출판부.
- 김재권, 1999, “창출의 의미”, 철학연구 , 95: 3–36.
- Kekulé A., 1858 [1963], Uber die Constitution und die Metamorphosen der chemischen Verbindungen und uber die chemische Natur des Kohlenstoffs. 앤. 화학 제약 , 106: 129–159. 페이지 참조는 Theodor Benfey (ed.) Classics in the theory of chemical 조합 , New York: Dover, 109–131 에서 "화학 화합물의 구성 및 변성 및 탄소의 화학적 성질"로 번역됩니다.
- Klein, Ursula, 1994, "화학 화합물 개념의 기원", 과학 맥락 , 7: 163–204.
- –––, 1995, “EF Geoffroy의 다양한 화학 물질 간의 다양한 '관계' 표 - 재해석”, Ambix , 42: 79–100.
- –––, 2003, 실험, 모델 및 종이 도구: 19세기의 유기 화학 문화 , Stanford: Stanford University Press.
- Kohler, Robert, 1971, "GN Lewis의 공유 쌍 결합 이론의 기원" , 물리 과학의 역사 연구 , 3: 343–376.
- –––, 1975, “본드 이론에 대한 GN 루이스의 견해, 1900–16.” 영국 과학사 저널 , 8: 233–239.
- Kragh, Helge, 2000, "화학의 개념적 변화: 화학 원소의 개념, ca. 1900–1925” 현대 물리학의 역사와 철학 연구 31B: 435–50.
- –––, 2002, “Vortex Atom: A Victorian Theory of Everything”, Centaurus , 44: 32–126.
- Kripke, Saul, 1980, 명명 및 필요성 , Oxford: Blackwell.
- Ladyman, James, 2011, "구조적 사실주의 대 표준 과학적 사실주의: 플로지스톤 및 디플로지스틱 공기의 경우", Synthese , 180: 87–101.
- Lavoisier, Antoine–Laurent, 1789 [1965], 모든 현대적 발견을 포함하는 새로운 체계적인 질서의 화학 요소 , trans. Traité Élémentaire de Chimie 의 Robert Kerr 저 , New York: Dover 증쇄.
- 르 포이데뱅. R., 2005, "Missing Elements and Missing Premises: A Combinatorial Argument for Ontological Reduction of Chemistry", British Journal for Philosophy of Science , 56: 117–134
- Lewis, GN, 1923 [1966], 원자가 및 원자 및 분자의 구조 , New York: Dover.
- Machamer, P., L. Darden 및 C. Craver, 2000, "기계에 대한 생각", 과학 철학 , 67: 1–25.
- Maiocchi, Roberto, 1990, "브라운 운동 사례", British Journal for the History of Science , 23: 257–83.
- Malt, Barbara, 1994, "물은 H 2 O 가 아닙니다 ", 인지 심리학 , 27: 41–70
- McMullin, E., 1985, "Galilean Idealization", 역사 및 과학 철학 연구 , 16: 247–73.
- Mendeleev, Dmitri, 1869 [2005], "원소의 속성과 원자량 간의 상관 관계에 대해", William B. Jensen (ed.), Mendeleev on the Periodic Law: Selected Writings, 1869–1905 , New York : 도버, 18–37.
- Meinel, Christoph, 1988, "17세기 초 원자론: 이론, 인식론, 실험의 부족", Isis , 79: 68–103.
- –––, 2004, "분자 및 크로켓 공", 모델: 과학의 3차원 , Soraya de Chadarevian 및 Nick Hopwood(편지), Stanford: Stanford University Press, pp. 242–275.
- Mulder, Peter, 2010, "오비탈이 존재하지 않는다는 주장", 현대 물리학의 역사 및 철학 연구 , 41: 178–82.
- Mulliken, RS, 1931, "전자의 결합력 및 원자가 이론", Chemical Reviews , 9: 347–88.
- Nagel, Ernest, 1961, 과학의 구조 , 런던: Routledge 및 Kegan Paul.
- Needham, Paul, 1996, "대체: 화학 패러다임에 대한 Duhem의 설명", Perspectives on Science , 4: 408–33.
- –––, 2000, “물이란 무엇인가?”, 분석 , 60: 13–21.
- –––, 2004, "원자는 언제 화학에서 어떤 설명 작업을 시작했습니까?", 과학 철학의 국제 연구 , 8: 199–219.
- –––, 2008, “물은 혼합물인가?—물리적 특성과 화학적 특성 사이의 구분 브리지”, 역사 및 과학 철학 연구 , 39: 66–77.
- –––, 2009a, "화학 물질의 아리스토텔레스 이론", 논리적 분석 및 철학의 역사 , 12: 149–64.
- –––, 2009b, “환원과 출현: 김에 대한 비판”, 『철학』 , 146: 93–116.
- –––, 2010a, "물질과 시간", 영국 과학 철학 저널 , 61: 485–512.
- –––, 2010b, “Nagel의 환원 분석: 비판뿐만 아니라 방어에 대한 논평”, 현대 물리학의 역사 및 철학 연구 , 41: 163–170.
- –––, 2011, “Microessentialism: 논증은 무엇인가?”, Noûs , 45(1): 1–21.
- –––, 2014, “화학 결합의 근원”, 과학사 및 철학 연구 , 45: 1–13.
- Newman, William R., 1996, "Robert Boyle의 Corpuscular Philosophy의 Alchemical Sources", Annals of Science , 53: 567–85.
- Norton, J., 1995, "발견 방법으로서의 제거적 귀납", J. Leplin(ed.), Creation of Ideas in Physics , Dordrecht: Kluwer, 29–69.
- Nye, Mary Jo, 1972, Molecular Reality , 뉴욕: Elsevier, 1972.
- Ostrovsky, VN, 2005, "'정확한' 과학의 근사화 철학을 향하여", Hyle: 화학 철학을 위한 국제 저널 , 11: 101–26.
- Ostwald, Wilhelm, 1904, "원소 및 화합물", Journal of the Chemical Society , 85: 506–22.
- Paneth, FA, 1962, "원소의 화학적 개념의 인식론적 상태", 영국 과학 철학 저널 , 13: 1–14, 144–160.
- Pauling, L., 1939, 화학 결합의 본질 , Ithaca: Cornell University Press.
- Perrin, Jean, 1913 [1990], Atoms , Ox Bow Press, Woodbridge, Connecticut.
- Platt, J., 1964, "강력한 추론", Science , 146: 347–353.
- Primas, H., 1981, Chemistry, Quantum Mechanics and Reductionism , New York: Springer-Verlag.
- 퍼트넘, 힐러리, 1975, "'의미'의 의미," 철학 논문 , Vol. 2, Cambridge: Cambridge University Press, pp. 215–71.
- –––, 1990, “물은 반드시 H2O인가?” in H. Putnam, Realism with a Human Face , Cambridge, MA: Harvard University Press, 54–79.
- Ramberg, P., 2003, 화학 구조, 공간 배열: 입체 화학의 초기 역사, 1874–1914 , Aldershot: Ashgate.
- Ramsey, J., 1997, "분자 모양, 환원, 설명 및 대략적인 개념", 합성 111: 233–251.
- Ritter, Christopher, 2001, "Alexander Crum Brown의 그래픽 공식의 초기 역사", 실험실 과학의 도구 및 표현 방식 , Ursula Klein(ed.), Dordrecht: Kluwer, pp. 35–46.
- Rocke, Alan J., 1984, 19세기의 화학 원자론: Dalton에서 Cannizzaro까지 , Columbus, OH: Ohio State University Press.
- –––, 2010, 이미지 및 현실: Kekulé, Kopp 및 과학적 상상력 , 시카고: 시카고 대학 출판부.
- Russell, Colin A., 1971, Valency의 역사 , 레스터: 레스터 대학 출판부.
- Scerri, Eric, 1991, "전자 구성 모델, 양자 역학 및 축소", 영국 과학 철학 저널 , 42: 309–25
- –––, 1994, "화학은 최소한 양자 역학으로 축소되었습니까?", D. Hull, M. Forbes 및 R. Burian(eds.), PSA 1994 (Vol. 1), Philosophy of Science Association.
- –––, 1997, “주기율표와 전자”, 미국 과학자 , 85: 546–553.
- –––, 2000, “궤도가 실제로 관찰되었습니까?”, Journal of Chemical Education , 77(11): 1492–4.
- –––, 2006, 주기율표: 그 이야기와 의미 , Oxford: Oxford University Press.
- Schaffner, K., 1967, "환원에 대한 접근", 과학 철학 , 34: 137–147.
- Schwarz, WH Eugen, 2007, "양자 물리학 개념의 도움으로 화학 원소의 주기 체계에 대한 과학적 설명을 향한 길에 대한 권장 질문", 기초 화학 , 9: 139–88.
- –––, 2006, "궤도 측정: 도발 또는 현실?", Angewandte Chemie International Edition , 45(10): 1508–17.
- Sklar, Lawrence, 1993, Physics and Chance: Philosophical Issues in Foundations of Statistical Mechanics , Cambridge: Cambridge University Press.
- Sutcliffe, BT 및 RG Woolley, 2012, "고전 화학 및 양자 역학의 원자 및 분자", 과학 철학 핸드북, 제6권: 화학 철학 , R. Hendry, P. Needham 및 A. Woody(eds. ), 암스테르담: Elsevier, 387–426.
- Todd, Robert B., 1976, Aphrodisias의 Alexander on Stoic Physics , Leiden: EJ Brill.
- van Brakel, Jaap, 1986, "물질의 화학과 질량 용어의 철학", Synthese , 69: 291–324.
- –––, 1997, "물질 변환의 과학으로서의 화학", Synthese , 111: 253–82.
- –––, 2000a, 화학 철학: 매니페스트와 과학적 이미지 사이 , Leuven: Leuven University Press.
- –––, 2000b, "화학 물질의 성질", N. Bhushan 및 S. Rosenfeld(편), 마음과 분자 , Oxford: Oxford University Press, pp. 162–84.
- Watson, James D., 1968, 이중 나선: DNA 구조 발견에 대한 개인 설명 , 뉴욕: New American Library.
- Weininger, Stephen J., 2014, "반응성과 그 맥락", Ursula Klein 및 Carsten Reinhardt(eds.), Objects of Chemical Inquiry , Leiden: Brill, 203–36.
- Weisberg, M., 2004, "질적 이론 및 화학적 설명". 과학 철학 , 71: 1071-1081.
- –––, 2005, "물은 H2O가 아닙니다." 화학 철학: 새로운 분야의 합성 , D. Baird, et al . (eds.), New York: Springer, 337–345.
- –––, 2007a, “모델러란?” 영국 과학 철학 저널 , 58: 207–233.
- –––, 2007b, “이상화의 세 가지” 철학 저널 , 104(12): 639–659.
- –––, 2008, “결합의 구조적 개념에 대한 도전”, 과학 철학 , 75: 932–946.
- Weisheipl, James A., 1963, "14세기 과학에서의 물질 개념", Ernan McMullin(ed.), 그리스어 및 중세 철학에서의 물질 개념 , Notre Dame: University of Notre Dame Press.
- Wikforss, Åsa, 2010, "Are Natural Kind Terms Special?", in H. Beebee and N. Sabbarton-Leary (eds.), The Semantics and Metaphysics of Natural Kinds , New York: Routledge, pp. 64–83.
- Wood, R. 및 M. Weisberg, 2004, "혼합물에 대한 아리스토텔레스 해석: Philoponus에서 Cooper까지의 원소 조성에 관한 문제", 과학의 역사 및 철학 연구 , 35: 681–706.
- Woody, AI, 2000, "Putting Quantum Mechanics to Work in Chemistry: Diagrammatic Representation", Philosophy of Science , 67: S612–27.
- –––, 2012, "양자 화학의 개념 융합 및 표현", 과학 철학 핸드북 (6권: 화학 철학), R. Hendry, P. Needham 및 A. Woody(eds.), 암스테르담: 엘스비어, 427-66.
- Woolley, R., 1978, "Must a Molecule have a shape?", Journal of the American Chemical Society , 100: 1073–1078.
- Zuo, JM, M. Kim, M. O'Keeffe 및 JCH Spence, 1999, " Cu 2 O 의 d 궤도 구멍 및 Cu-Cu 결합 의 직접 관찰", Nature , 401(6748): 4952.
학업 도구
이 항목을 인용하는 방법 . SEP Society 의 친구들에서 이 항목의 PDF 버전을 미리 보십시오 . 인터넷 철학 온톨로지 프로젝트(InPhO)에서 이 항목과 관련된 주제와 사상가를 찾아보십시오 . 데이터베이스에 대한 링크와 함께 PhilPapers 에서 이 항목 에 대한 향상된 참고 문헌.
기타 인터넷 리소스
- Hoffmann, Roald, 2009, " 유대감 을 갖는 모든 방법 ", 국제 화학 철학 학회의 기조 연설.
- 국제 화학 철학 학회 .
- HYLE--화학 철학을 위한 국제 저널 .
- 케미컬 헤리티지 재단 홈페이지 .
- 미국 화학 학회 .
- 순수 및 응용 화학 국제 연합 .
감사의 말
저자는 Brad Berman, Mark Goodwin, Roald Hoffmann, Deena Skolnick Weisberg 및 Stanford Encyclopedia 편집자에게 매우 유용한 의견과 조언을 해주셔서 감사합니다. 일부 수치를 제공한 Simon Garcia와 Gabriel Merino에게도 감사드립니다.
Philosophy of Chemistry (Stanford Encyclopedia of Philosophy)
Chemistry is the study of the structure and transformation of matter. When Aristotle wrote the first systematic treatises on chemistry in the 4th century BCE, his conceptual grasp of the nature of matter was tailored to accommodate a relatively simple rang
plato.stanford.edu
Copyright © 2019 by
Michael Weisberg < weisberg @ phil . 우펜 . 교육 >
폴 니덤 < 폴 . 니덤 @ 철학 . 수 . se >
로빈 헨드리 < r . 에프 . 헨 드리 @ 더럼 교류 . 영국 >
'화학(공학)' 카테고리의 다른 글
| 화학 (0) | 2022.11.02 |
|---|---|
| 화학철학 -구조식 (0) | 2022.10.31 |
| 열역학 - 에너지에 대한 화학적 지식 (0) | 2022.09.23 |
| 물리화학적 사회학 다이어그램 (0) | 2022.09.22 |
| 인간 화학 열역학 (HCT) (0) | 2022.09.22 |


