화학에서중소체증이라고도 하는 공명은 원자가 결합 이론에서 여러 기여 구조(또는형태,[1]공명 구조 또는표준 구조라고도 함)를 공명 하이브리드(또는하이브리드 구조)로결합하여 특정분자또는다원자 이온의결합을 설명하는 방법입니다. . 결합이 하나의단일 루이스 구조로 표현될 수 없는비편재화 전자를 분석하는 데 특별한 가치가 있습니다.

목차
개요편집하다
원자가 결합 이론의 틀에서 공명은화학 종의결합이 루이스 구조로 설명될 수 있다는 생각의 확장입니다. 많은 화학 종의 경우,옥텟 규칙을 따르는 원자로 구성되고,형식 전하를 띠고, 양의 정수 순서의 결합으로 연결된 단일 루이스 구조는 화학 결합을 설명하고결합 길이, 각도 및쌍극자 모멘트와 같은 실험적으로 결정된 분자 특성을 합리화하기에 충분합니다. [2] 그러나 경우에 따라 둘 이상의 루이스 구조가 그려질 수 있으며 실험 특성이 하나의 구조와 일치하지 않습니다. 이러한 유형의 상황을 해결하기 위해 여러 기여 구조가 평균으로 함께 고려되며, 분자는 실제 구조를 설명하기 위해 여러 루이스 구조가 집합적으로 사용되는 공명 하이브리드로 표현된다고합니다.
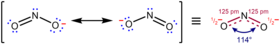
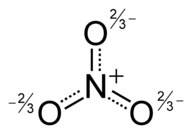
예를 들어, NO2–,아질산염음이온에서 단일 루이스 구조가 동일한 형식 결합 순서를 가진 두 개의 N-O 결합을 갖지 않더라도 두 개의 N–O결합 길이는 동일합니다. 그러나 측정 된 구조는 위에 표시된 두 가지 주요 기여 구조의 공명 하이브리드로서의 설명과 일치합니다 : 전형적인 N-O 단일 결합(하이드 록실 아민에서 145pm, H2N-OH)과 N-O 이중 결합 (니트로 늄 이온에서 115pm, [O = N = O] +). 기여 구조에 따르면 각 N-O 결합은 형식적 단일 및 형식 이중 결합의 평균이며 실제 결합 순서는 1.5입니다. 이 평균화 덕분에 NO2의 결합에 대한 루이스의 설명은 음이온이 동등한 N-O 결합을 갖는다는 실험적 사실과 조화를 이룹니다.
공명 하이브리드는 실제 분자를 기여 구조의 "평균"으로 나타내며, 결합 길이와부분 전하는기여자의 개별 루이스 구조에 대해 예상되는 값과 비교하여 중간 값을 취합니다. [3] 기여 구조는 원자에 대한 전자의공식적인배분에서만 다르며 실제 물리적 및 화학적으로 중요한 전자 또는 스핀 밀도에서는 다릅니다. 기여 구조는 공식적인 결합 순서와공식적인 전하할당에서 다를 수 있지만, 모든 기여 구조는 동일한 수의 원자가 전자와 동일한 스핀다중도를 가져야합니다. [4]
전자 비편재화는 시스템의 위치 에너지를 낮추기 때문에 공명 하이브리드로 표시되는 모든 종은 (가설) 기여 구조보다 더 안정적입니다. [5] 전자 비편재화는 전자가 분자 전체에 더 고르게 퍼져 전자-전자 반발을 감소시키기 때문에 분자를 안정화시킵니다. [6] 실제 종과 가장 낮은 위치 에너지를 가진 기여 구조의 (계산된) 에너지 사이의 위치 에너지의 차이를공명 에너지[7] 또는 비편재화 에너지라고 합니다. 공명 에너지의 크기는 가상의 "비 안정화"종과 사용 된 계산 방법에 대한 가정에 의존하며 측정 가능한 물리량을 나타내지는 않지만 유사한 가정 및 조건에서 계산 된 공명 에너지의 비교는 화학적으로 의미 할 수 있습니다.
선형 폴리엔 및 다방향족 화합물과 같은 확장된 π계를 가진 분자는분자 궤도 이론에서 비편재화된 궤도뿐만 아니라 공명 하이브리드에 의해 잘 설명됩니다.
공명 대 이성질체편집하다
공명은이성질체와 구별되어야 합니다. 이성질체는 동일한 화학식을 가진 분자이지만 공간에서 원자핵의 배열이 다른 별개의 화학 종입니다. 반면에 분자의 공명 기여자는 분자의 루이스 구조묘사에서 전자가 원자에 공식적으로 할당되는 방식에서만 다를 수 있습니다. 특히, 분자 구조가 공명 하이브리드로 표현된다고 말할 때, 분자의 전자가 각각 루이스 구조로 표현되는 여러 위치 세트 사이에서 "공명"하거나 앞뒤로 이동한다는 것을 의미하지는 않습니다. 오히려 기여 구조 집합이중간 구조 (기여자의 가중 평균)를 나타내며, 잘 정의 된 단일 기하학과 전자 분포를 나타냅니다. 공명 하이브리드를 빠르게 상호 변환 이성질체로 간주하는 것은 올바르지 않습니다., 비록 "공명"이라는 용어가 그러한 이미지를 불러일으킬 수 있음에도 불구하고. [8](아래에서 설명하는 바와 같이, "공명"이라는 용어는 양자 역학 현상에 대한 고전 물리학 비유로 시작되었으므로 너무 문자 그대로 해석해서는 안됩니다.) 상징적으로 양방향 화살표{\displaystyle {\ce {A<->B}}}
A와 B가 단일 화학 종의 기여 형태임을 나타내는 데 사용됩니다 (평형 화살표와 반대로,{\displaystyle {\ce {A <=> B}}}
; 사용법에 대한 자세한 내용은아래를 참조하십시오).
비 화학적 비유는 예시입니다 : 실제 동물 인일각 고래의 특성을 두 개의 신화 생물, 즉 머리에 하나의 뿔이있는 생물인 유니콘과 고래와 같은 큰 생물 인리바이어던의 특성으로 설명 할 수 있습니다. 일각고래는 유니콘이 되는 것과 리바이어던이 되는 것 사이를 오가는 생물이 아니며, 유니콘과 리바이어던은 인간의 집단적 상상력 밖에서 물리적 존재를 가지고 있지 않습니다. 그럼에도 불구하고 이러한 상상의 생물의 관점에서 일각 고래를 설명하는 것은 물리적 특성에 대한 합리적으로 좋은 설명을 제공합니다.
공명이라는 단어의 물리적 의미와의 혼동으로 인해 실제로 물리적으로 "공명"하는 개체가 없기 때문에 공명이라는 용어는 비편재화를 위해 포기하고[9]공명 에너지는비편재화 에너지를 위해 포기하는 것이 제안되었습니다. 공진 구조는기여구조가되고 공진 하이브리드는하이브리드 구조가됩니다. 양방향 화살표는 일련의 구조를 설명하기 위해 쉼표로 대체되며, 모든 유형의 화살표는 화학 변화가 일어나고 있음을 초급 학생에게 암시 할 수 있습니다.
다이어그램의 표현편집하다
다이어그램에서 기여 구조는 일반적으로 양방향 화살표(↔)로 구분됩니다. 화살표를 오른쪽 및 왼쪽을 가리키는평형 화살표(⇌)와 혼동해서는 안 됩니다. 모든 구조는 함께 큰 대괄호로 묶여있을 수 있으며, 이는화학 평형에서 다른 종이 아닌 하나의 단일 분자 또는 이온을 나타냅니다.
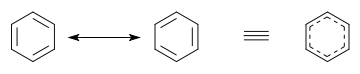
다이어그램에서 기여 구조를 사용하는 대신 하이브리드 구조를 사용할 수 있습니다. 하이브리드 구조에서 공명에 관여하는 파이 결합은 일반적으로 곡선[10] 또는 점선으로 표시되며, 이는 이것이 정상적인 완전한 파이 결합이 아닌 부분적인 결합임을 나타냅니다. 벤젠 및 기타 방향족 고리에서 비편 재화 된 파이 전자는 때때로 고체 원으로 묘사됩니다. [11]
역사편집하다
이 개념은 1899 년Johannes Thiele의 "부분 원자가 가설"에서 1865 년에 제안 된August Kekulé의 구조에서 기대할 수없는 벤젠의 비정상적인 안정성을 설명하기 위해 처음 등장했습니다. [12] 벤젠은알켄에 전형적인 부가 반응보다는 치환 반응을 겪습니다. 그는 벤젠의 탄소-탄소 결합이 단일 및 이중 결합의 중간체라고 제안했습니다.
공명 제안은 또한 벤젠 유도체의 이성질체 수를 설명하는 데 도움이되었습니다. 예를 들어, Kekulé의 구조는 브롬화 탄소 원자가 단일 또는 이중 결합으로 연결된 2개의오르토이성질체를 포함하여4개의디브로모벤젠 이성질체를 예측합니다. 실제로 디브로모벤젠 이성질체는 3개뿐이며 하나만 오르토이며, 단일 결합과 이중 결합 사이의 중간인 탄소-탄소 결합의 한 가지 유형만 있다는 생각과 일치합니다. [13]
공명 메커니즘은 1926 년Werner Heisenberg가 헬륨 원자의 양자 상태에 대한 논의에서양자 역학에 도입되었습니다. 그는 헬륨 원자의 구조를 결합고조파 발진기를 공진시키는 고전적인 시스템과 비교했습니다. [3][14]클래식 시스템에서 커플링은 두 가지 모드를 생성하며, 그 중 하나는 결합되지 않은 진동보다주파수가 낮습니다. 양자 역학적으로이 낮은 주파수는 더 낮은 에너지로 해석됩니다. 라이너스 폴링 (Linus Pauling)은이 메커니즘을 사용하여 1928 년에 분자의 부분 원자가를 설명했으며 1931-1933 년에 일련의 논문에서 더 발전시켰다. [15][16]대체 용어mesomerism[17]같은 의미의 독일어와 프랑스어 출판물에서 인기 있는 것은 1938년C. K. Ingold에 의해 소개되었지만 영문학에서는 채택되지 않았습니다. mesomeric 효과의 현재 개념은 관련이 있지만 다른 의미를 취했습니다. 쌍두 화살표는 독일어 문구zwischenstufe또는중간 단계를 선호하는 독일 화학자Fritz Arndt에 의해 소개되었습니다.
소련에서는 특히 폴링이 개발 한 공명 이론이 1950 년대 초변증 법적 유물론의 마르크스주의 원칙에 위배된다는 공격을 받았으며 1951 년 6 월알렉산더 네스 메야 노프의지도하에 소련 과학 아카데미는 400 명의 물리학 자들이 참석 한 유기 화합물의 화학 구조에 관한 회의를 소집했다. 화학자, 철학자, "공명 이론의의사 과학적본질이 노출되고 가면이 벗겨졌다". [18]
주요 및 부 기여자편집하다
하나의 기여 구조는 다른 분자보다 실제 분자와 더 유사 할 수 있습니다 (에너지와 안정성의 의미에서). 위치 에너지 값이 낮은 구조는 높은 값을 가진 구조보다 안정적이며 실제 구조와 더 유사합니다. 가장 안정적인 기여 구조를주요 기여자라고 합니다. 정력적으로 불리하고 따라서 덜 유리한 구조는사소한 기여자입니다. 중요도가 감소하는 대략적인 순서로 나열된 규칙에서 주요 기여자는 일반적으로 다음과 같은 구조입니다.
- 가능한 한 옥텟 규칙을 준수하십시오 (결함이나 잉여가 아닌 각 원자 주위에 8 개의 원자가 전자,또는 기간 1 원소의 경우 2 개의 전자);
- 최대 수의 공유 결합을 갖는다.
- 공식적으로 하전된 원자를 최소한으로 운반하며, 각각 다른 전하와 유사한 전하의 분리가 최소화되고 최대화됩니다.
- 가장 전기 음성도가 높은 원자에 음전하를 놓고 가장전기 음성적인원자에 양전하를 놓습니다.
- 이상적인 결합 길이 및 각도에서 크게 벗어나지 않습니다 (예 : 벤젠에 대한 Dewar-type 공명 기여자의 상대적 중요성).
- 방향족 하부 구조를 국부적으로 유지하면서 반 방향족 하부 구조를 피하십시오 (Clar sextet및biphenylene 참조).
최대 8개의 원자가 전자는 주기 2 원소 Be, B, C, N, O 및 F에 대해 엄격하며 H와 He의 경우최대 2개이며 Li에 대해서도 효과적입니다. [19] 세 번째 기간의 원자가 껍질과 더 무거운 주요 그룹 요소의 확장 문제는 논란의 여지가 있습니다. 중심 원자가 8보다 큰 원자가 전자 수를 갖는 루이스 구조는 전통적으로 결합에 d 궤도의 참여를 의미합니다. 그러나 합의 된 의견은 그들이 한계 기여를 할 수 있지만 d 궤도의 참여는 중요하지 않으며 소위초가분자의 결합은 대부분3 중심 4 전자 결합을 묘사하는 전하 분리 기여 형태로 더 잘 설명된다는 것입니다. 그럼에도 불구하고, 전통적으로 확장 된 옥텟 구조는 예를 들어 설폭 사이드, 설폰 및인 일 라이드와 같은 작용기에 대해 여전히 일반적으로 그려집니다. 실제 전자 구조를 반드시 반영하지는 않는 형식주의로 간주되는 이러한 묘사는 부분 결합, 전하 분리 또는 날짜 결합을 특징으로하는 구조보다IUPAC에서 선호합니다. [20]
동등한 기여자는 실제 구조에 동등하게 기여하는 반면, 동등하지 않은 기여자의 중요성은 위에 나열된 속성을 준수하는 정도에 따라 결정됩니다. 더 많은 수의 중요한 기여 구조와 비편재화 전자에 사용할 수 있는 더 방대한 공간은 분자의 안정화(에너지 저하)로 이어집니다.
예제편집하다
방향족 분자편집하다
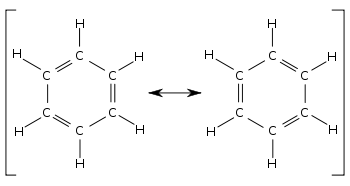
벤젠에서 Kekulé가 처음 제안한 두 개의 시클로 헥사 트리 엔Kekulé 구조는 전체 구조를 나타내는 기여 구조로 함께 사용됩니다. 오른쪽의 하이브리드 구조에서 점선 육각형은 3 개의 이중 결합을 대체하고π대칭의 3 개의 분자 궤도 세트에서 6 개의 전자를 나타내며분자평면의노드 평면을 나타냅니다.
푸란에서는 산소 원자의고독한 쌍이 탄소 원자의 π 궤도와 상호 작용합니다. 곡선 화살표는비편재화 π 전자의 순열을 나타내며, 이로 인해 다른 기여자가 발생합니다.
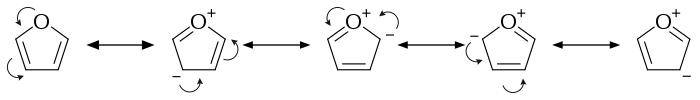
전자가 풍부한 분자편집하다
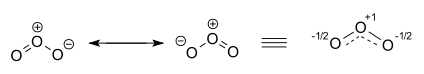
오존분자는 두 가지 기여 구조로 표현됩니다. 실제로 두 개의 말단 산소 원자는 동등하며 하이브리드 구조는 산소 원자와 부분 이중 결합 모두에서 -1⁄2의 전하를 띠고 오른쪽에 그려지며 전체 및 점선과결합 순서를 갖습니다. 11⁄2+. [21][22]
다가 분자의 경우, 위에서 설명한 합리화를 적용하여 이러한분자의 결합을 설명하는 기여 구조를 생성 할 수 있습니다. 아래는크세논 디플루오라이드에서3c-4e결합의 기여 구조입니다.
{\displaystyle {\ce {[{\mathsf {F-XeF^{-}<->F^{-}Xe-F}}]}}}전자 결핍 분자편집하다
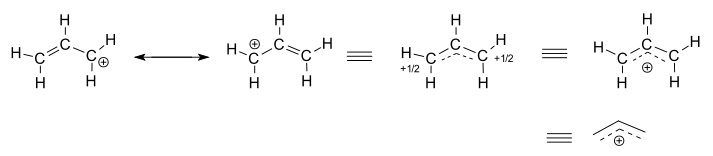
알릴 양이온은 말단 탄소 원자에 양전하를 띠는 두 개의 기여 구조를 가지고 있습니다. 하이브리드 구조에서 전하는 +1⁄2입니다. 완전한 양전하는 또한 3 개의 탄소 원자 사이에서 비편 재화 된 것으로 묘사 될 수있다.
디보란분자는 각각 다른 원자에 전자 결핍이 있는 기여 구조로 설명됩니다. 이것은 각 원자의 전자 결핍을 줄이고 분자를 안정화시킵니다. 다음은 디보란에서 개별3c-2e결합의 기여 구조입니다.
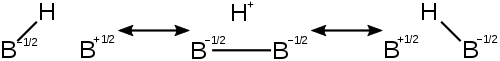
반응성 중간체편집하다
| 더 알아보세요
|
종종탄수화물및자유 라디칼과 같은 반응성 중간체는 모 반응물보다 비편재화 구조가 더 많아 예상치 못한 생성물을 생성합니다. 고전적인 예는알릴 재 배열입니다. 1 몰의 HCl이 1 몰의 1,3- 부타디엔에 첨가되면 일반적으로 예상되는 생성물 인 3- 클로로 -1- 부텐 외에도 1- 클로로 -2- 부텐도 발견됩니다. 동위 원소 표지 실험에 따르면 여기서 일어나는 일은 일부 제품에서 추가 이중 결합이 1,2 위치에서 2,3 위치로 이동하는 것입니다. 이 증거와 다른 증거 (예 :초산성용액의NMR)는 중간 탄수화물이 대부분 고전적 (비 편 재화가 존재하지만 작은) 모 분자와는 다른 고도로 비편 재화 된 구조를 가져야한다는 것을 보여줍니다. 이 양이온(알릴 양이온)은 위에 표시된 것처럼 공명을 사용하여 나타낼 수 있습니다.
덜 안정적인 분자에서 더 큰 비편재화에 대한 이러한 관찰은 매우 일반적입니다. 공액디엔의 여기 상태는 기저 상태보다 접합에 의해 더 안정화되어 유기 염료가됩니다.
π 전자를 포함하지 않는 잘 연구 된 비편 재화 (과다 접합)의 예는 비 고전적2- 노르 보르 닐 양이온에서 관찰 될 수있다. 또 다른 예는메탄입니다. (채널+
5). 이들은 3 개의중심 2 전자 결합을 포함하는 것으로 볼 수 있으며 σ 전자의 재 배열을 포함하는 기여 구조 또는 세 지점에 3 개의 핵이있는 특수 표기법 인 Y로 표현됩니다.
비편재화 전자는 여러 가지 이유로 중요합니다. 중요한 것은 전자가 보다 안정적인 구성으로 비편재화되어 다른 위치에서 반응이 일어나기 때문에 예상되는 화학 반응이 일어나지 않을 수 있다는 것입니다. 예를 들어 1- 클로로 -2- 메틸 프로판으로 벤젠의Friedel-Crafts알킬화; 탄수화물 양이온은비편재화의 특정 형태인과접합에 의해 안정화된tert-부틸기로 재배열됩니다. 비편재화는 전자의 파장을 길게하므로 에너지가 감소합니다.
벤젠편집하다
본드 길이편집하다
벤젠의 두 가지 기여 구조를 비교하면 모든 단일 결합과 이중 결합이 서로 바뀝니다. 결합 길이는예를 들어X선 회절을 사용하여 측정할 수 있습니다. C-C 단일 결합의 평균 길이는154pm입니다. C=C 이중 결합의 결합은 오후 133시입니다. 국소화 된 시클로 헥사 트리엔에서 탄소 – 탄소 결합은 154와 133 pm을 번갈아 가며 이루어져야합니다. 대신, 벤젠의 모든 탄소-탄소 결합은 단일 결합과 이중 결합 사이의 결합 길이 중간인 약 139pm으로 밝혀졌습니다. 이 혼합 된 단일 및 이중 결합 (또는 삼중 결합) 특성은 결합이 다른 기여 구조에서 다른결합 순서를갖는 모든 분자에 일반적입니다. 채권 길이는 채권 주문을 사용하여 비교할 수 있습니다. 예를 들어, 시클로헥산에서 결합 순서는 1이고 벤젠의 결합 순서는 1 + (3 ÷ 6) =11⁄2+. Consequently, benzene has more double bond character and hence has a shorter bond length than cyclohexane.
Resonance energyEdit
Resonance (or delocalization) energy is the amount of energy needed to convert the true delocalized structure into that of the most stable contributing structure. The empirical resonance energy can be estimated by comparing the enthalpy change of hydrogenation of the real substance with that estimated for the contributing structure.
The complete hydrogenation of benzene to cyclohexane via 1,3-cyclohexadiene and cyclohexene is exothermic; 1 mole of benzene delivers 208.4 kJ (49.8 kcal).

이중 결합 1 몰의 수소화는 마지막 단계 인 시클로 헥센의 수소화에서 추론 할 수있는 바와 같이 119.7 kJ (28.6 kcal)를 전달합니다. 그러나 벤젠에서는 이중 결합 1 몰을 수소화하기 위해 23.4kJ (5.6kcal)가 필요합니다. 143.1kJ (34.2kcal)의 차이는 벤젠의 경험적 공명 에너지입니다. 1,3-사이클로헥사디엔은 또한 작은 비편재화 에너지(7.6 kJ 또는 1.8 kcal/mol)를 가지고 있기 때문에 국부적인 사이클로헥사트리엔에 비해 순 공명 에너지는 151 kJ 또는 36 kcal/mol로 약간 더 높습니다.[23]
이 측정된 공명 에너지는 세 개의 '비공진' 이중 결합의 수소화 에너지와 측정된 수소화 에너지의 차이이기도 합니다.
(3 × 119.7) − 208.4 = 150.7 kJ / mol (36 kcal). [24]원자가 결합(VB) 이론의 양자역학적 설명편집하다
공명은원자가 결합 이론(VB)의 수학적 형식주의에서 더 깊은 의미를 갖습니다. 양자 역학은 분자의 파동 함수가 관찰 된 대칭을 따를 것을 요구합니다. 단일 기여 구조가이를 달성하지 못하면 공명이 호출됩니다.
예를 들어, 벤젠에서 원자가 결합 이론은 실제 분자의 6중 대칭을 개별적으로 소유하지 않는 두 개의 Kekulé 구조로 시작됩니다. 이 이론은 실제 파동 함수를 두 구조를 나타내는파동함수의 선형 중첩으로 구성합니다. 두 Kekulé 구조는 동일한 에너지를 가지고 있기 때문에 전체 구조에 동일한 기여를합니다 - 중첩은 동일한 가중 평균 또는 벤젠의 경우 둘의 1 : 1 선형 조합입니다. 대칭 조합은 바닥 상태를 제공하고 반대칭 조합은 그림과 같이 첫 번째여기 상태를 제공합니다.
일반적으로 중첩은 결정되지 않은 계수로 작성되며, 주어진 기본 파동 함수 세트에 대해 가능한 가장 낮은 에너지를 찾기 위해가변 최적화됩니다. 더 많은 기여 구조가 포함되면 분자파 함수가 더 정확해지고 기여 구조의 다양한 조합에서 더 많은 여기 상태를 파생할 수 있습니다.
분자 궤도 (MO) 이론과의 비교편집하다
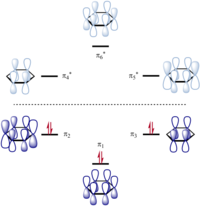
원자가 결합 이론의 주요 대안인 분자궤도 이론에서 분자 궤도(MO)는 모든 원자에 대한모든 원자 궤도(AO)의 합으로 근사됩니다. AO만큼 많은 MO가 있습니다. 각각의AOi는 특정 MO에 대한 AO의 기여도를 나타내는가중계수ci를 갖는다. 예를 들어, 벤젠에서 MO 모델은 6개의 C 원자 각각에 대한 2pzAO의 조합인 6개의 π MO를 제공합니다. 따라서 각 π MO는 전체 벤젠 분자에 걸쳐 비편재화되고 MO를차지하는모든 전자는 전체 분자에 걸쳐 비편재화됩니다. 이 MO 해석은 벤젠 고리를 내부에 원이 있는 육각형으로 묘사하는 데 영감을 주었습니다. 벤젠을 설명 할 때 국부적 인 σ 결합의 VB 개념과 비편 재화 된 π 궤도의 MO 개념은 초등 화학 과정에서 자주 결합됩니다.
VB 모델의 기여 구조는 벤젠과 같은 π 시스템에 대한치환기의영향을 예측하는 데 특히 유용합니다. 그들은 벤젠에 대한 전자철수 그룹과 전자방출 그룹에기여하는 구조의 모델로 이어집니다. MO 이론의 유용성은 원자 π계로부터의 전하의 정량적 표시가 원자 Ci에 대한가중계수ci의 제곱으로부터 얻어 질 수 있다는 것이다. 충전qi≈c
2 나. 계수를 제곱하는 이유는 전자가 AO로 설명되면 AO의 제곱이전자 밀도를 제공하기 때문입니다. AO는 AO2= 1 및 q i≈ (ciAO i)2≈c가 되도록 조정(정규화)됩니다.
2 나. 벤젠에서 qi = 각 C 원자에 1. 오르토및파라C 원자에 전자끌기 그룹 qi< 1 및전자 방출 그룹에 대해 qi> 1을 갖는 경우.
계수편집하다
전체 구조에 대한 기여도 측면에서 기여 구조의 가중치는 원자가 결합 이론에서 파생 된 "Ab initio"방법을 사용하거나 WeinholdNBO5Archived2008-02-08 atWayback Machine의자연 결합 궤도 (NBO) 접근법을 사용하거나 마지막으로 Hückel 방법을 기반으로 한 경험적 계산에서 여러 가지 방법으로 계산할 수 있습니다. 공명 교육을 위한 Hückel 방법 기반 소프트웨어는HuLiS웹 사이트에서 사용할 수 있습니다.
전하 비지역화편집하다
이온의 경우 비편재화 된 전하 (전하 비편 재화)에 대해 이야기하는 것이 일반적입니다. 이온에서 비편재화된 전하의 예는카르복실레이트그룹에서 찾을 수 있으며, 여기서 음전하는 2개의 산소 원자에 균등하게 중심을 둔다. 음이온의 전하 비편재화는 반응성(일반적으로 비편재화 정도가 높을수록 반응성이 낮음)과 특히 공액 산의 산 강도를 결정하는 중요한 요소입니다. 일반적으로 비편재화될수록 음이온의 전하가 더 강할수록공액 산이 강해집니다. 예를 들어,과염소산염음이온의 음전하(ClO−
4)는 대칭 배향 된 산소 원자 사이에 고르게 분포되어 있습니다 (그리고 그 일부는 또한 중심 염소 원자에 의해 유지됩니다). 많은 수의 산소 원자 (4 개) 및 중심 염소 원자의 높은전기 음성도와결합 된이 우수한 전하 비편 재화로 인해과염소산은 pK값이 -10 인 가장 강력한 알려진 산 중 하나가됩니다. [26] 음이온에서 전하 비편재화의 정도는 WAPS(가중 평균 양성 시그마) 파라미터[27]파라미터를 통해 정량적으로 표현할 수 있고, 유사한 WANS(가중 평균 네거티브 시그마)[28][29] 파라미터가 양이온에 사용된다.
| (C2F5SO2) 2 NH | 2.0[30] | 트리페닐포스핀 | 2.1[28] |
| (참조3) 3 증권 시세 표시기 | 3.6[30] | 페닐테트라메틸구아니딘 | 2.5[28] |
| 피크린산 | 4.3[27] | 트리프로필아민 | 2.6[28] |
| 2,4-디니트로페놀 | 4.9[27] | MTBD (7- 메틸 - 트리 아자비 시클로 데센) | 2.9[29] |
| 벤조산 | 7.1[27] | DBU (1,8- 디아 자비 사이클로 운덱 -7- 엔) | 3.0[29] |
| 페놀 | 8.8[30] | TBD (트리 아자비 시클로 데센) | 3.5[29] |
| 아세트산 | 16.1[27] | N, N- 디메틸 아닐린 | 4.7[28] |
| 안녕 | 21.9[30] | 피리딘 | 7.2[28] |
| 증권 시세 표시기 | 29.1[30] | 아닐린 | 8.2[28] |
| 제이씨. | 35.9[27] | 프로필아민 | 8.9[28] |
WAPS 및 WANS 값은e/Å4로 주어진다. 더 큰 값은 해당 이온에서 더 많은 국부적 인 전하를 나타냅니다.
참고 항목편집하다


외부 링크편집하다
- 구다드, N.; 카리 산, Y.; 하게바움-레니어, D.; 험벨, S. (2008). "HuLiS : Java Applet - Simple Hückel Theory and Mesomery - program logiciel software"(프랑스어). 2010년 10월 29일에 확인함.
참조편집하다
- ^ IUPAC, 화학 용어 개요, 2nd ed. ( "골드 북") (1997). 온라인 수정 버전: (2006–) "공명". 도이 : 10.1351 / 골드 북. R05326
- ^ IUPAC, 화학 용어 개요, 2nd ed. ( "골드 북") (1997). 온라인 수정 버전: (2006–) "기여 구조". 도이 : 10.1351 / 골드 북. 씨01309
- ^ a b 폴링, 라이너스 (1960). "공명의 개념". 화학 결합의 본질 – 현대 구조 화학 소개(3판). 코넬 대학 출판부. 10–13쪽. ISBN978-0801403330.
- ^ 공명과 비편재화의 개념에 익숙한 실습 화학자는 종종 공명 하이브리드를 호출하여 구조를 설명해야 하는 분자를 암시적으로 표현하기 위해 하나의 주요 기여 구조만 그릴 것입니다. 예를 들어, 화학자는 독자가 오른쪽에 표시된 다른 기여자를 알고 있다는 이해와 N-O 결합이 실제로 동일하다는 의미와 함께 왼쪽에 표시된 NO2의 공명 기여자를 임의로 그릴 수 있습니다. 이 관행은 특히 유기 화학에서 널리 퍼져 있으며,벤젠의Kekulé 구조중 하나가 분자의 규칙적인 육각형 구조를 묘사하기 위해 자주 선택됩니다.
- ^ 모리슨, 로버트; 보이드, 로버트 (1989). "제 10 장". 유기 화학 (5 판). 인도의 프렌 티스 홀. 피. 372. ISBN978-0-87692-560-7. 공진 하이브리드는 기여 구조보다 더 안정적입니다.
- ^ 캐리, 프랜시스 A.; 선드버그, 리처드 J. (2007). 고급 유기 화학 파트 A : 구조 및 메커니즘. 뛰는 사람. 피. 19. ISBN978-0-387-68346-1.
- ^ IUPAC, 화학 용어 개요, 2nd ed. ( "골드 북") (1997). 온라인 수정 버전: (2006–) "공명 에너지". 도이 : 10.1351 / 골드 북. R05333
- ^ "공명 형태". UCDavis 화학 위키. UCDavis. 2013-10-02. 2015년 10월 7일에 확인함.
- ^ 케르버, 로버트 C. (2006). "공명이라면 공명하는 것은 무엇입니까?". J. 화학 에듀크. 83(2): 223. 참고 문헌 : 2006JChEd.. 83..223케이. 도이 : 10.1021 / ED083P223.
- ^ "화학 구조 다이어그램에 대한 그래픽 표현"(PDF), IUPAC 권장 사항 2008, IUPAC, p. 387 (GR–8)
- ^ "화학 구조 다이어그램에 대한 그래픽 표현"(PDF), IUPAC 권장 사항 2008, IUPAC, pp. 379–382 (GR–6)
- ^ 틸레, 요하네스 (1899). "Zur Kenntnis der ungesättigten Verbindungen"[[기여] 불포화 화합물에 대한 우리의 지식]. Justus Liebig의 Annalen der Chemie(독일어). 306: 87–142. 도이 : 10.1002 / JLAC.18993060107. p. 89에서 Thiele은 "부분 원자가"의 개념을 소개했습니다. einePartialvalensvorhanden ist, eine Annahme, die sich auch thermisch begründen lässt." (이제 나는 이중 결합이 기인하는 물질의 경우, 실제로 참여하는 각 원자의 두 가지 친화력이 결합에 사용된다고 가정합니다. 그러나 이중 결합의 추가 능력으로 인해 친화력의 힘은 완전히 소비되지 않으며 각 원자에는 친화력의 잔여 또는 "부분 원자가"가 존재합니다. 열적으로도 입증 될 수있는 가정 [즉, 열량계를 통해].) 90쪽에서 Thiele은 "conjugated"라는 용어를 만들었습니다: "Ein solches System benachbarter Doppelbindungen mit ausgeglichenen inneren Partialvalenzen sei alsconjugirtbezeichnet." (균등화 된 내부 부분 원자가를 갖는 인접한 이중 결합 시스템을 "공액 (conjugated)"이라고합니다.) Thiele은 pp. 125–129:VIII에서 벤젠의 공액 구조에 대해 논의했습니다. Die aromatischen Verbindungen. 다스 벤졸. (VIII. 방향족 화합물. 벤젠.)
- ^ 혼백, 조셉 M. (2006). 유기 화학 (2 판). 톰슨 학습. 470–1쪽. ISBN9780534389512.
- ^ 폴링, 라이너스, 공명, p. 1
- ^ "라이너스 폴링의 과학과 인본주의". 2012년 3월 31일에 원본 문서에서 보존된 문서.섹션 1의 마지막 단락을 참조하십시오.
- ^ 폴링, L. (1960). 화학 결합의 본질(3판). 옥스포드 대학 출판부. p.184. 이 자료에서 폴링은 먼저 1931년슬레이터와휘켈의 관련 논문을 언급한 다음 자신의 주요 논문인 폴링, 라이너스를 인용합니다. (1931). "화학 결합의 본질. ii. 1 전자 결합과 3 전자 결합". J. Am. 화학 Soc. 53(1367): 3225. 도이 : 10.1021 / JA01360A004. 그리고 1932-33년의 후속 논문.
- ^ IUPAC, 화학 용어 개요, 2nd ed. ( "골드 북") (1997). 온라인 수정 버전: (2006–) "메소메리즘". 도이 : 10.1351 / 골드 북. M03845
- ^ 무어, 배링턴 주니어 (1954). 테러와 진보 소련: 소비에트 독재의 변화와 안정의 몇 가지 원천. 142–143쪽.
- ^ 리튬은 항상 이온 화합물에서 Li로 발견됩니다.+(1s2), 듀엣. 어느 정도의 공유 결합을 갖는 CH3Li와 같은 화합물에서, 결합은 주로 2p 오비탈로부터 약간의 기여와 함께 2s 오비탈과 함께 달성된다. (이 결합 방식은 (CH3Li)4와 같은 응축 상 응집체에도 사용되어 리튬의 배위 수가 높아집니다.) 따라서 원칙적으로 최대 옥텟을 수용 할 수 있습니다. 그럼에도 불구하고, Li 주변의 원자가 전자의 공식적인 수는 중성 리간드와의 약한 공여체-수용체 상호 작용 (예 : 루이스 구조에서 종종 생략 된 용매 분자)이 포함되지 않는 한 결코 2를 초과하지 않습니다.
- ^ 브레처, 조나단 (2008-01-01). "화학 구조 다이어그램에 대한 그래픽 표현 표준 (IUPAC 권장 사항 2008)". 순수 및 응용 화학. 80(2): 277–410. 도이 : 10.1351 / PAC200880020277. ISSN1365-3075.
- ^ 웨이드, G. 유기 화학 (6 판). [ISBN 누락]
- ^ 브루스, 폴라 Y. 유기 화학 (4 판). [ISBN 누락]
- ^ 위버그; 나카지; 모건 (1993). "시스이민의 수소화 열. 실험적이고 이론적 인 연구". J. Am. 화학 Soc. 115(9): 3527–3532. 도이 : 10.1021 / JA00062A017.
- ^ 셔먼, J. (1939년 2월). "불포화 탄화수소의 수소화 열". J. Am. 오일 화학 Soc. 16(2): 28. 도이 : 10.1007 / BF02543208. S2CID96029597. 2011년 7월 14일에원본문서에서 보존된 문서.
- ^ 샤이크, 새슨 S.; 하이버티, 필립 C. (2008). 원자가 결합 이론에 대한 화학자의 가이드. 뉴저지: 와일리-인터사이언스. 200–203쪽. ISBN978-0-470-03735-5.
- ^ 판매자, 캐슬린; 주, 캐서린; 알솝, 윌리엄 R.; 클러프, 스티븐 R.; 호이트, 마릴린; 퓨, 바바라 (2006). 과염소산 염 : 환경 문제 및 해결책. CRC 프레스. 피. 16. ISBN978-0-8493-8081-5.
- ^ a b c d e f 카우프미스, K.; 칼 주란드, I.; 레이토, I. (2010). "아세토니트릴의 산도에 대한 수분 함량의 영향. 음이온의 전하 비편재화 정량화". J. 물리 화학. A. 114(43): 11788–11793. 참고 문헌 : 2010JPCA.. 11411788케이. 도이 : 10.1021 / JP105670T. PMID20919704.
- ^abcdefg h 카우프미스, K.; 칼 주란드, I.; 레이토, I. (2014). "아세토니트릴의 염기성에 대한 수분 함량의 영향". J. 솔루트. 화학. 43(7): 1270–1281. 도이 : 10.1007 / S10953-014-0201-4. S2CID95538780.
- ^ a b c d 카우프미스, K.; 트럼말, A.; 레이토, I. (2014). "물에서 강한 염기의 기초 : 계산 연구". 크로아티아. 화학 액타. 87(4): 385–395. 도이 : 10.5562 / CCA2472.
- ^ a b c d e 라마트, E.; 카우프미스, K.; 오브스야니코프, G.; 트럼말, A.; 퀴트, A.; 사메, J.; 코펠, I.; 칼 주란드, I.; 리핑, L.; 로디 마, T.; 필, V.; 코펠, I. A.; 레이토, I. (2013). "다른 매체에서 강한 중성 Brønsted 산의 산도". J. 물리 조직. 화학. 26(2): 162–170. 도이 : 10.1002 / poc.2946.